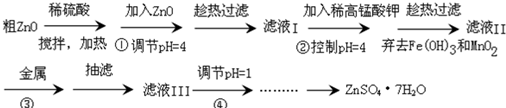
题目内容
12.甲、乙两烧杯中各盛有100mL 3mol/L的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=2:3,则加入铝粉的质量为( )| A. | 1.8 g | B. | 2.7 g | C. | 4.05g | D. | 5.4 g |
分析 由2Al+6HCl═2AlCl3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,酸碱足量,生成气体相同;金属足量,酸碱不足,生成气体为1:3,由铝的质量相同,盐酸和氢氧化钠溶液中溶质的物质的量相同,应结束后测得生成的气体体积比为甲:乙=2:3,由化学反应方程式可知,酸与金属反应时酸不过量,碱与金属反应时碱过量来计算解答,据此分析解答.
解答 解:盐酸和氢氧化钠溶液中溶质的物质的量均为0.1L×3mol/L=0.3mol,
又两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=2:3,
设铝与酸反应时酸完全反应,生成的氢气的物质的量为x,
则 2Al+6HCl═2AlCl3+3H2↑
6 3
0.3mol x
x=$\frac{0.3mol×3}{6}$=0.15mol,
一定条件下,气体的物质的量之比等于体积之比,
则碱与金属铝反应生成的氢气的物质的量为0.15mol×$\frac{3}{2}$=0.225mol,
碱与金属铝反应时铝完全反应,设与碱反应的铝的物质的量为y,
则 2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2 3
y 0.225mol
y=$\frac{0.225mol×2}{3}$=0.15mol,
则Al的质量为0.15mol×27g/mol=4.05g,
故选C.
点评 本题考查Al的化学性质及利用化学反应方程式的计算,为高频考点,把握铝与酸、碱反应水的化学反应方程式,酸碱足量、酸碱均不足量时得到的氢气的关系是解答本题的关键,题目难点较大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 25℃时若1 mL pH=1的盐酸与100 mL 氨水溶液混合后,溶液的pH=7,则氨水溶液的pH=11 | |
| B. | 将0.2 mol•L-1盐酸与0.1 mol•L-1的KAlO2溶液等体积混合,溶液中离子浓度由小到大的顺序:c(OH-)<c(H+)<c(Al3+)<c(K+)<c(Cl-) | |
| C. | pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液:c(NH4+)大小顺序为②>①>③ | |
| D. | 0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| A. | Na和O2 | B. | NaOH溶液和AlCl3溶液 | ||
| C. | Fe和Cl2 | D. | NaOH溶液和CO2 |
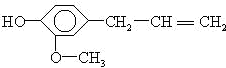 据此结构分析,下列说法正确的是( )
据此结构分析,下列说法正确的是( )| A. | 可以燃烧,只能与溴水发生加成反应 | |
| B. | 可与NaOH溶液反应,也可与FeCl3溶液反应 | |
| C. | 不能与金属钠反应放出H2 | |
| D. | 可以与小苏打溶液反应放出CO2气体 |
| A. | 0.5mol | B. | 0.75mol | C. | 1.25mol | D. | 1.5mol |
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1 452kJ•mol-1
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列说法正确的是( )
| A. | H2(g)的燃烧热为571.6 kJ•mol-1 | |
| B. | 0.5H2SO4(aq)+0.5Ba(OH)2(aq)═0.5BaSO4(s)+H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 | |
| D. | 3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4 kJ•mol-1 |
| A. | 汽车尾气中的CO﹑NO等都是汽油和柴油的不完全燃烧产物 | |
| B. | 氢键﹑离子键﹑共价键都是微粒间的作用力,其中离子键和共价键属于化学键 | |
| C. | 高压钠灯发出的黄光射程远,透雾能力强,常用于道路和广场的照明 | |
| D. | 锅炉水垢中的硫酸钙可用碳酸钠饱和溶液处理,使之转化为碳酸钙,再用酸除去 |
| A. | 熟石灰与水混合成糊状后会很快凝固,转化为坚硬的生石膏,可用它制作石膏绷带 | |
| B. | 人造纤维是利用自然界的非纤维材料通过化学合成方法得到的 | |
| C. | 雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理 | |
| D. | 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可减少“白色污染” |