题目内容
18.短周期元素X、Y,X元素原子的最外层电子数与次外层电子数的差值等于电子层数;Y元素原子的最外层电子数比X元素原子的最外层电子数多2,则X与Y所形成的化合物的化学式为( )| A. | X3Y2 | B. | X2Y | C. | X2Y5 | D. | XY3 |
分析 因原子最外层电子数≤8,所以,X原子的次外层只能为2,即X原子有两个电子层,设最外层电子数为m,则m-2=2,则m=4;由此可知,Y原子最外层有6个电子,进而判断形成的物质.
解答 解:X元素原子的最外层电子数与次外层电子数的差值等于电子层数,因原子最外层电子数≤8,所以,X原子的次外层只能为2,即X原子有两个电子层,设最外层电子数为m,则m-2=2,则m=4,故X为C元素;Y元素原子比X元素原子的最外层电子数多2,可知Y原子最外层有6个电子,表现-2价,二者只能形成化合物XY2,
故选:D.
点评 本题考查原子结构和性质,明确原子核外电子排布是解本题关键,题目难度中等.

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目
15.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向盛有二氧化锰的锥形瓶中滴入浓盐酸 | 产生黄绿色气体 | 氧化性:MnO2>Cl2 |
| B | 分别向水和乙醇中投入等质量、等大小的金属钠 | 水中产生气泡较快 | 羟基中氢的活泼性:H2O>乙醇 |
| C | 向滴有KSCN试剂的Fe(NO3)2的溶液中加入盐酸 | 溶液变红 | Fe2+被盐酸氧化为Fe3+ |
| D | 向饱和石灰水中加入Na2O2 | 有白色沉淀析出 | Na2O2与Ca(OH)2反应生成白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
13.硒是人体必须的微量元素,下列关于${\;}_{34}^{78}$Se与${\;}_{34}^{80}$Se的说法正确的是( )
| A. | ${\;}_{34}^{78}$Se与${\;}_{34}^{80}$Se都含有34个中子 | |
| B. | ${\;}_{34}^{78}$Se与${\;}_{34}^{80}$Se分别含有44和46个质子 | |
| C. | ${\;}_{34}^{78}$Se与${\;}_{34}^{80}$Se因含有相同的质子数故互为同位素 | |
| D. | ${\;}_{34}^{78}$Se与${\;}_{34}^{80}$Se含有相同的电子数,因此性质一样 |
3.下列说法正确的是( )
| A. | 在由水电离产生的氢离子浓度为10-13 mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3-四种离子能大量共存 | |
| B. | 已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.82×10-6 | |
| C. | 对于反应2N2H4(l)=N2(g)+2H2(g),△H=-50.6 kJ?mol-1,它只在高温下自发进行 | |
| D. | 常温下,将0.2 mol?L-1某一元碱(ROH)溶液和0.1 mol?L-1HCl溶液等体积混合,混合后溶液pH<7,则c(ROH)>c(R+) |
10.下列实验操作中有错误的是( )
| A. | 用蒸馏水润湿的试纸测某溶液的pH,一定会使结果偏低 | |
| B. | 蒸馏操作时,冷却水应从冷凝管的下口通入,上口流出 | |
| C. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸发操作时,当有较多晶体析出时,停止加热 |
7.化学与生活、生产密切相关,下列说法正确的是( )
| A. | 对“地沟油”进行分馏可得到汽油 | |
| B. | PM2.5、CO2都属于空气质量日报的内容 | |
| C. | 硅酸多孔、吸水能力强,常用作袋装食品的干燥 | |
| D. | 向煤中加入适量CaSO4,可大大减少燃烧产物中SO2的量 |
8.下面的排序不正确的是( )
| A. | 热稳定性由高到低:NH3>PH3 | B. | 晶体熔点由高到低:SiC14>SiO2 | ||
| C. | 酸性由强到弱:HC1O4>HC1O | D. | 晶体熔点由高到低:MgO>MgCl2 |

 .
. .
.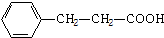 .
. 单体.
单体.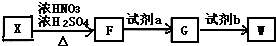
 ,试剂a为酸性KMnO4 溶液.
,试剂a为酸性KMnO4 溶液. $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +(n-1)H2O.
+(n-1)H2O.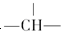 ,则该结构的烃的一氯取代物最多可能有几种(不考虑立体异构)( )
,则该结构的烃的一氯取代物最多可能有几种(不考虑立体异构)( )