题目内容
18.下面是元素周期表的一部分,表中所列字母分别代表某一化学元素.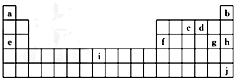
(1)c元素在周期表中的位置第二周期VA族
(2)e、f两元素的最高价氧化物对应水化物之间反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O
(3)i的一种红棕色氧化物可以与f单质发生反应,该反应的化学方程式为Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe
(4)e与g形成的化合物类型为离子化合物(填“离子”或“共价”),用电子式表示其形成过程为

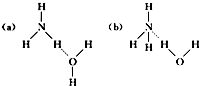
(5)NH3•H2O的电离方程式NH3•H2O?NH4++OH-,试判断NH3溶于水后,形成的NH3•H2O的合理结构B(填字母代号).
(6)利用稀有气体化合物,人们实现了许多制备实验上的突破.如用j的+6价氧化物在碱性条件下与NaBrO3反应生成NaBrO4,同时生成j的单质.写出上述反应的方程式XeO3+3NaBrO3=3NaBrO4+Xe.
分析 根据元素在周期表中的分布,可以知道:a是H,b是He,c是N,d是O,e是Na,f是Al,g是Cl,h是Ar,i是Fe,j是Xe.
(1)由c的位置可知,处于周期表中第二周期VA族;
(2)e、f两元素的最高价氧化物对应水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水;
(3)i的一种红棕色氧化物为Fe2O3,与Al单质发生铝热反应生成氧化铝与Fe;
(4)e与g形成的化合物为MgCl2,属于离子化合物;
(5)氨水的电离生成NH4+、OH-,说明NH3•H2O 中O-H键发生断裂,来确定氨水的结构和成键情况;
(6)j的+6价氧化物为XeO3,在碱性条件下与NaBrO3反应生成NaBrO4,同时生成Xe的单质.
解答 解:根据元素在周期表中的分布,可以知道:a是H,b是He,c是N,d是O,e是Na,f是Al,g是Cl,h是Ar,i是Fe,j是Xe.
(1)由c的位置可知,处于周期表中第二周期VA族,
故答案为:第二周期VA族;
(2)e、f两元素的最高价氧化物对应水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)i的一种红棕色氧化物为Fe2O3,与Al单质发生铝热反应生成氧化铝与Fe,反应方程式为:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,
故答案为:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(4)e与g形成的化合物为MgCl2,属于离子化合物,用电子式表示形成过程为: ,
,
故答案为:离子; ;
;
(5)NH3溶于水后,形成的NH3•H2O中,NH3•H2O的电离方程式为NH3•H2O
故答案为:B;
(6)j的+6价氧化物为XeO3,在碱性条件下与NaBrO3反应生成NaBrO4,同时生成Xe的单质,反应方程式为:XeO3+3NaBrO3=3NaBrO4+Xe,
故答案为:XeO3+3NaBrO3=3NaBrO4+Xe.
点评 本题考查元素周期表、元素化合物性质、常用化学用语、分子结构与性质、氢键等,难度中等,侧重对基础知识的应用与学生分析能力的考查.

 名校课堂系列答案
名校课堂系列答案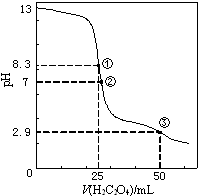 25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )
25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-) | |
| B. | 点②所示溶液中:c(HC2O4-)+2c(C2O42-)=c(Na+) | |
| C. | 点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| D. | 滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-) |
①质子数相同的粒子一定属于同种元素
②同位素的物理性质有较大差别而化学性质几乎相同
③元素种类由质子数决定,核素种类由质子数和中子数共同决定,元素主要化学性质 由最外层电子数决定
④电子数相同的粒子不一定是同一种元素
⑤每种元素都有两种或两种以上的核素.
| A. | ①②④ | B. | ③④⑤ | C. | ②③⑤ | D. | ①⑤ |
| A. | 由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 | |
| B. | Ksp只与难溶电解质的性质和温度有关 | |
| C. | 其他条件不变,离子浓度改变时,Ksp不变 | |
| D. | 两种难溶电解质,Ksp小的,溶解度一定小 |
| A. | 难挥发 | B. | 不能与水互溶 | C. | 能燃烧 | D. | 不能和乙酸反应 |
| A. | 某溶液中加稀硫酸生成无色气体,说明原溶液中有CO32- | |
| B. | 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42- | |
| C. | 某无色溶液滴入紫色石蕊溶液显红色,该溶液一定显碱性 | |
| D. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3,有白色沉淀生成,证明含Cl- |
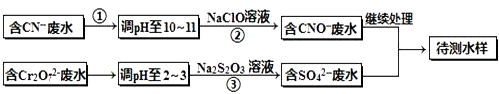
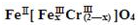 (铁氧磁体,罗马数字表示元素价态)的沉淀.
(铁氧磁体,罗马数字表示元素价态)的沉淀.