题目内容
如图为元素周期表短周期的一部分.下列关于A~F六种元素的叙述正确的是( )

| A、A、B、D、E四种元素所形成的最高价含氧酸中D的酸性最强 |
| B、形成的简单阴离子半径的大小顺序为:C>B>D>E |
| C、D、E、F三种元素形成的单质中都含有共价键 |
| D、1 mo1A、B、C元素的简单氢化物中都含有10 mol电子 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:这几种元素都是短周期元素,根据元素在周期表中的位置知,A、B、C、D、E、F分别是C、N、F、S、Cl、Ar元素,
A.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
B.离子电子层数越多其离子半径越大,电子层结构相同的离子,其离子半径随着原子序数增大而减小;
C.稀有气体中不存在化学键;
D.每个C、N、F元素的氢化物分子中都含有10个电子.
A.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
B.离子电子层数越多其离子半径越大,电子层结构相同的离子,其离子半径随着原子序数增大而减小;
C.稀有气体中不存在化学键;
D.每个C、N、F元素的氢化物分子中都含有10个电子.
解答:
解:这几种元素都是短周期元素,根据元素在周期表中的位置知,A、B、C、D、E、F分别是C、N、F、S、Cl、Ar元素,
A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性E最强,所以A、B、D、E四种元素所形成的最高价含氧酸中E的酸性最强,故A错误;
B.离子电子层数越多其离子半径越大,电子层结构相同的离子,其离子半径随着原子序数增大而减小,D、E离子有3个电子层,B、C离子有两个电子层,所以离子半径大小顺序是:D>E>B>C,故B错误;
C.稀有气体中不存在化学键,所以F中不存在化学键,只存在分子间作用力,故C错误;
D.每个C、N、F元素的氢化物分子中都含有10个电子,所以1 mo1A、B、C元素的简单氢化物中都含有10 mol电子,故D正确;
故选D.
A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性E最强,所以A、B、D、E四种元素所形成的最高价含氧酸中E的酸性最强,故A错误;
B.离子电子层数越多其离子半径越大,电子层结构相同的离子,其离子半径随着原子序数增大而减小,D、E离子有3个电子层,B、C离子有两个电子层,所以离子半径大小顺序是:D>E>B>C,故B错误;
C.稀有气体中不存在化学键,所以F中不存在化学键,只存在分子间作用力,故C错误;
D.每个C、N、F元素的氢化物分子中都含有10个电子,所以1 mo1A、B、C元素的简单氢化物中都含有10 mol电子,故D正确;
故选D.
点评:本题考查元素周期表和元素周期律综合应用,侧重考查学生对物质结构、元素周期律的掌握,知道离子半径比较方法,注意稀有气体分子构成的特殊性,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列下列化学用语正确的是( )
| A、三氯化铁溶液中加入铁粉Fe3++Fe═2Fe2+ |
B、过氧化钠电子式: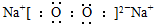 |
C、Na+结构简图: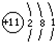 |
| D、少量氯气通入溴化亚铁溶液中2FeBr2+3Cl2═2FeCl3+2 Br2 |
沼气是有机废弃物(树叶、桔杆、草类及垃圾、粪便等)在隔绝空气的条件下发酵分解而成的气体,主要成分是甲烷.农村沼气池中发酵后的池底剩余物是很好的沤肥.下面有关结论中,错误的是( )
| A、沼气是一种清洁能源 |
| B、使用沼气级农民的生活带来了不便 |
| C、使用沼气作能源可以保护森林 |
| D、使用沼气是对化学能的充分利用 |
下列说法不正确的是( )
| A、已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 |
| B、SO2、SO3都是极性分子 |
| C、实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键 |
| D、金属具有的光泽是金属吸收光子而发生跃迁发出特定波长的光波 |
干燥剂的干燥性能可用干燥效率(1m3空气中实际余留水蒸气的质量)来衡量.某些干燥剂的干燥效率数据如下分析以上数据,下列有关叙述错误的是.( )
| 物质 | 干燥效率 | 物质 | 干燥效率 |
| MgO | 0.008 | ZnCl2 | 0.8 |
| CaO | 0.2 | ZnBr2 | 1.1 |
| A、MgO的干燥性能比CaO好 |
| B、干燥效率可能与干燥剂的阴、阳离子的半径大小有关 |
| C、MgCl2可能是比CaCl2更好的干燥剂 |
| D、上述干燥剂中阳离子对干燥剂性能的影响比阴离子小 |
由CO、CH4和C2H2组成的混合气体4.48L(标况),在足量氧气中充分燃烧后,生成的气体先通过足量的浓H2SO4再通过足量的NaOH溶液,NaOH溶液增重13.2g,则混合气体中含C2H2的物质的量n为( )
| A、n<0.1mol |
| B、n=0.1mol |
| C、0.1mol<n<0.15mol |
| D、无法确定 |