题目内容
5.根据原子结构及元素周期律的知识,下列推断正确的是( )| A. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 | |
| B. | S2?、Cl?、K+、Ca2+半径逐渐增大 | |
| C. | 核外电子排布相同的微粒化学性质也相同 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
分析 A、最外层电子数相同所以得电子能力相同;
B、电子层结构相同,核电数越多半径越小;
C、核外电子排布相同的微粒,化学性质不一定相同,如Ar原子与S2-离子;
D、同主族元素最高价含氧酸自上而下酸性减弱;
解答 解:A、${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl质子数相同,所以最外层电子数相同,得电子能力相同,故A正确;
B、电子层结构相同,核电数越多半径越小,所以半径大小为:S2->Cl->K+>Ca2+,故B错误;
C、核外电子排布相同的微粒,化学性质不一定相同,如Ar原子化学性质稳定,而S2-离子具有强还原性,故C错误;
D、同主族元素最高价含氧酸自上而下酸性减弱,不是最高价含氧酸不一定,如HClO为弱酸、HBrO4为强酸,故D错误;
故选A.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素周期律、周期表中的族序数、原子序数等关系为解答的关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.3molA和2.5molB混合盛入容积为2L的容器内,使它们发生反应2A(s)+3B(g)?2C(g)+D(g),经过5min生成0.5molD,下列说法正确的是( )
| A. | B的平均消耗速率为0.3mol(L•min) | |
| B. | C的平衡浓度为2mol/L | |
| C. | 平衡后,增大压强,平衡将向正方向移动 | |
| D. | 若单位时间内生成的B和C的物质的量之比为3:2,则体系处于平衡状态 |
20.已知同一碳原子连有两个羟基不稳定: .下列关于有机物
.下列关于有机物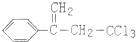 (除草剂,俗称稗草烯)的说法不正确的是( )
(除草剂,俗称稗草烯)的说法不正确的是( )
 .下列关于有机物
.下列关于有机物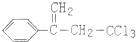 (除草剂,俗称稗草烯)的说法不正确的是( )
(除草剂,俗称稗草烯)的说法不正确的是( )| A. | 能使酸性高锰酸钾溶液褪色 | |
| B. | 在足量NaOH溶液中充分水解,可生成羧酸钠 | |
| C. | 可用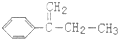 与Cl2在光照条件下通过取代反应获得较纯的该物质 与Cl2在光照条件下通过取代反应获得较纯的该物质 | |
| D. | 在一定条件下可发生聚合反应 |
17.下图所示与对应叙述相符的是( )
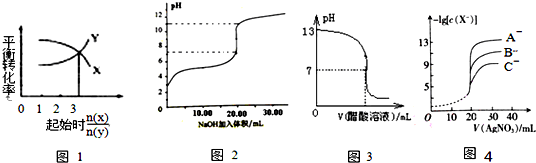

| A. | 一定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X+3Y?Z | |
| B. | 图2表示NaOH溶液滴加到0.1 mol/L的一元酸溶液得到的滴定曲线(常温下),该实验最好选取酚酞作指示剂 | |
| C. | 常温下,向NaOH溶液中逐滴加入等浓度的醋酸溶液,所得滴定曲线如图3所示.当7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图4可确定首先沉淀的是A- |
14.向盛有乙醇的烧杯中投入一小块金属钠,可以观察到的现象是( )
| A. | 钠块沉在乙醇液面下面 | B. | 钠块熔成小球 | ||
| C. | 钠块在乙醇液面上游动 | D. | 钠块表面无气泡产生 |
15.下列电离方程式书写错误的是( )
| A. | Na2CO3═2Na++CO32- | B. | H2O═2H++O2- | ||
| C. | HNO3═H++NO3- | D. | K2SO4═2K++SO42- |
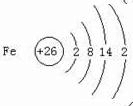 .与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为KOH+HBrO4=KBrO4+H2O.
.与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为KOH+HBrO4=KBrO4+H2O. 如图咖啡酸,存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好.
如图咖啡酸,存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好.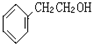 .
. 的一种同分异构体,A的苯环上有三个取代基,能发生银镜反应,苯环上的一氯代物有两种.写出A的一种结构简式:
的一种同分异构体,A的苯环上有三个取代基,能发生银镜反应,苯环上的一氯代物有两种.写出A的一种结构简式: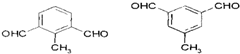 .
.