题目内容
7.铝、铁是重要的金属,其单质及化合物有着广泛的应用,完成下列填空:(1)铝元素在周期表中的位置是第三周期第ⅢA族,写出其最高价氧化物对应水化物的电离方程式H++AlO2-+H2O?Al(OH)3?Al3++3OH-.
(2)画出铁原子的结构示意图
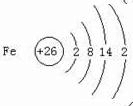 .与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为KOH+HBrO4=KBrO4+H2O.
.与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为KOH+HBrO4=KBrO4+H2O.(3)在FeC13稀溶液中滴加KSCN溶液后呈红色,反应的离子方程式是Fe3++3SCN-=Fe(SCN)3;在其中加入少量KCl固体,溶液的颜色不变(选填“变深”,“变浅”或“不变”).
(4)若先往FeCl3溶液中加入足量NaF溶液,再滴加溶液,则不呈红色,若再加入足够量FeC13溶液,又会呈现红色.请试对上述实验现象作出解释Fe3+更易与F-结合,生成更为稳定的无色FeF63-,所以再滴加KSCN时,溶液不呈红色,再滴加足量FeCl3时,Fe3+又与SCN-结合,生成Fe(SCN)3,所以又呈现红色.
分析 (1)铝的原子序数是13,核外13个电子.有三个电子层,最外层有3个电子,其最高价氧化物对应水化物是氢氧化铝,溶液中存在碱式电离和酸式电离;
(2)铁是26号元素,原子核外有四个电子层,最外层2个电子;与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物为KOH,酸性最强的化合物为HBrO4,酸碱中和反应生成盐和水;
(3)在FeC13稀溶液中滴加KSCN溶液后呈红色是铁离子的特征性质,铁离子和硫氰根离子形成络合物的反应是可逆反应;
(4)若先往FeCl3溶液中加入足量NaF溶液,再滴加KSCN溶液,则不呈红色说明铁离子和氟离子发生反应生成络离子,加入足量FeCl3溶液,溶液又呈血红色,说明SCN-加入的过量.
解答 解:(1)铝的原子序数是13,核外13个电子.有三个电子层,最外层有3个电子,位于周期表中第三周期第ⅢA族,铝的最高价氧化物对应水化物为Al(OH)3,氢氧化铝是两性氢氧化物,溶液中存在酸式电离和碱式电离,电离方程式为:H++AlO2-+H2O?Al(OH)3?Al3++3OH-,
故答案为:第三周期第ⅢA族;H++AlO2-+H2O?Al(OH)3?Al3++3OH-;
(2)铁是26号元素,原子核外有四个电子层,最外层2个电子,原子结构示意图为: ,与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物为KOH,酸性最强的化合物为HBrO4,酸碱都是一元酸碱,中和反应生成盐和水,反应的化学方程式为:KOH+HBrO4=KBrO4+H2O,
,与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物为KOH,酸性最强的化合物为HBrO4,酸碱都是一元酸碱,中和反应生成盐和水,反应的化学方程式为:KOH+HBrO4=KBrO4+H2O,
故答案为: ;KOH+HBrO4=KBrO4+H2O;
;KOH+HBrO4=KBrO4+H2O;
(3)铁离子和硫氰酸根离子反应生成血红色溶液,形成平衡的离子方程式为:Fe3++3SCN-=Fe(SCN)3,若在其中加入少量KCl固体,溶解后形成的氯离子和钾离子对平衡无影响,平衡状态和氯化钾的离子浓度无关,所以平衡不动,溶液颜色不变,
故答案为:Fe3++3SCN-=Fe(SCN)3;不变;
(4)若先往FeCl3溶液中加入足量NaF溶液,再滴加KSCN溶液,则不呈红色,证明铁离子和氟离子发生反应生成更为稳定的无色FeF63-络离子,若再加入足够量FeCl3溶液.又会呈现红色,说明SCN-没有被消耗,
故答案为:Fe3+更易与F-结合,生成更为稳定的无色FeF63-,所以再滴加KSCN时,溶液不呈红色,再滴加足量FeCl3时,Fe3+又与SCN-结合,生成Fe(SCN)3,所以又呈现红色.
点评 本题考查了化学平衡影响因素、原子结构的分析,主要是平衡移动原理的分析判断,注意:Fe3++3SCN-=Fe(SCN)3,影响平衡的离子分析判断,掌握基础是关键,题目难度中等.

| 北京市医疗机构临床检验结果报告单 | ||||
| 分析项目 | 检测结果 | 单位 | 参考范围 | |
| 1 | 锌(Zn) | 115.92 | μmol/L | 66-120 |
| 2 | 铁(Fe) | 6.95↓ | mmol/L | 7.52-11.82 |
| 3 | 钙(Ca) | 1.68 | mmol/L | 1.55-2.10 |
| … | ||||
(1)该儿童铁(或Fe)元素含量偏低.
(2)报告单中“μmol/L”是浓度(填“质量”、“体积”或“浓度”)的单位.
(3)服用维生素C可使食物中的Fe3+转化为Fe2+.在这个过程中体现维生素C的还原性(填“氧化性”或“还原性”).
(4)缺铁性贫血患者应补充Fe2+.一些补铁剂以硫酸亚铁为主要成分,用硫酸亚铁制成药片时外表包有一层特殊的糖衣,推测糖衣的作用是防止Fe2+被氧化.
①浓硫酸存在时,能与CH3CH2OH、CH3COOH反应
②浓硫酸存在时,能脱水生成一种使溴水褪色的物质,该物质只存在一种结构
③浓硫酸存在时,能生成一种分子式为C4H6O2的五元环状化合物
则C4H8O3的结构简式为( )
| A. | HOCH2COOCH2CH3 | B. | HOCH2CH2CH2COOH | C. | CH3CH(OH)CH2COOH | D. | CH3CH2CH(OH)COOH |
| A. | 低温高压 | B. | 高温低压 | C. | 低温低压 | D. | 高温高压 |
| A. | 每摩尔H2O2分子含2NA个氧原子 | |
| B. | 标准状况下,22.4L水中含有NA个水分子 | |
| C. | 16g甲烷分子中含4NA个氢原子 | |
| D. | 100mL 1mol/L Na2SO4溶液含有0.2NA个Na+ |
| A. | 化合价升降总数不等 | B. | 这两个反应的类型不相同 | ||
| C. | 产物种类相同 | D. | 硫元素价态变化相同 |
| A. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 | |
| B. | S2?、Cl?、K+、Ca2+半径逐渐增大 | |
| C. | 核外电子排布相同的微粒化学性质也相同 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |