题目内容
17.下图所示与对应叙述相符的是( )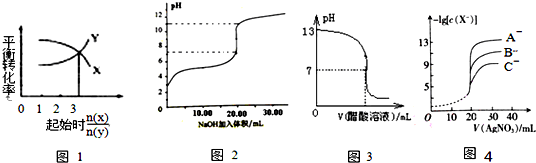
| A. | 一定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X+3Y?Z | |
| B. | 图2表示NaOH溶液滴加到0.1 mol/L的一元酸溶液得到的滴定曲线(常温下),该实验最好选取酚酞作指示剂 | |
| C. | 常温下,向NaOH溶液中逐滴加入等浓度的醋酸溶液,所得滴定曲线如图3所示.当7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图4可确定首先沉淀的是A- |
分析 A、当反应物的起始物质的量之比等于化学计量数之比,物质的转化率相同,据此由图可知$\frac{n(X)}{n(Y)}$=3时,转化率相同,即X与Y的化学计量数之比为3:1;
B、根据0.1 mol/L的一元酸在滴定开始时的pH来判断酸为弱弱酸,强碱滴定弱酸用酚酞作指示剂;
C、如NaOH过量较多,可存在c(OH-)>c(CH3COO-);
D、由图象可知,-lgc(X-)越大,则c(X-)越小,越先生成沉淀.
解答 解:A、解:当反应物的起始物质的量之比等于化学计量数之比,物质的转化率相同,据此由图可知$\frac{n(X)}{n(Y)}$=3时,转化率相同,即X与Y的化学计量数之比为3:1,故反应为3X+Y?Z,故A错误;
B、滴定开始时0.1 mol•L-1某酸pH为3,所以酸为弱酸,强碱滴定弱酸用酚酞作指示剂,故B正确;
C、如NaOH过量较多,可存在c(OH-)>c(CH3COO-),故C错误;
D、由图象可知,-lgc(X-)越大,则c(X-)越小,越先生成沉淀,由图4曲线,可确定首先沉淀的是A-,故D正确,
故选BD.
点评 本题考查较为综合,涉及学生的分析能力的考查,为高考高频考点和常见题型,注意把握图象曲线的变化特点,为解答该题的关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.已知:将Cl2通入适量NaOH溶液,产物中可能有NaCl、NaClO、NaClO3,且$\frac{c(C{l}^{-})}{c(Cl{O}_{3}^{-})}$的值仅与温度高低有关.当n(NaOH)=6a mol时,下列有关说法不正确的是( )
| A. | 改变温度,反应中转移电子的物质的量n的范围:3a mol≤n≤5a mol | |
| B. | 改变温度,产物中NaCl的最小理论产量为4a mol | |
| C. | 参加反应的氯气的物质的量3a mol | |
| D. | 某温度下,若反应后$\frac{c(C{l}^{-})}{c(Cl{O}_{3}^{-})}$=6,则溶液中$\frac{c(C{l}^{-})}{c(Cl{O}_{3}^{-})}$=6 |
5.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 | |
| B. | S2?、Cl?、K+、Ca2+半径逐渐增大 | |
| C. | 核外电子排布相同的微粒化学性质也相同 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
12.现有7瓶失去标签的液体,它们可能是:乙醇、乙酸、苯、乙酸乙酯、油脂、葡萄糖溶液和蔗糖溶液.现通过如下实验步骤来确定各试剂瓶中所装的液体:
试给它们的试剂瓶重新贴上标签:
A乙醇,B乙酸,C苯,D乙酸乙酯,E油脂,F葡萄糖溶液,G蔗糖溶液.
| 实验步骤和方法 | 实验现象 |
| ①把7瓶液体分别依次标号A、B、C、D、E、F、G后,闻气味 | 只有F、G两种液体没有气味 |
| ②各取少量于试管中加水稀释 | 只有C、E、D三种液体不溶解而浮在水面上 |
| ③分别取少量7种液体于试管中加新 制Cu(OH)2悬浊液并加热 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
| ④各取少量C、E、D于试管中,加稀NaOH 溶液并加热 | 加热前D的试管中闻 到特殊香味,加热后只有C仍有分层现象 |
A乙醇,B乙酸,C苯,D乙酸乙酯,E油脂,F葡萄糖溶液,G蔗糖溶液.
2.下列离子在无色溶液中大量共存的是( )
| A. | Fe3+、Na+、SCN-、Cl- | B. | Na+、H+、NO3-、SO42- | ||
| C. | Na+、OH-、H+、NO3- | D. | Fe2+、NH4+、Cl-、OH- |
9.下列各组反应,最终一定能得到白色沉淀的是( )
| A. | 向Na2SiO3溶液中加入稀盐酸 | |
| B. | 将CO2通入CaCl2溶液中 | |
| C. | 向FeCl2溶液中加入过量NaOH溶液 | |
| D. | 向Al2(SO4)3溶液中加入过量NaOH溶液 |
7.由N2O和NO反应生成N2和NO2的能量变化如图所示.下列说法不正确的是( )
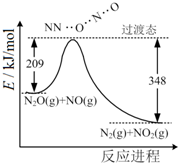

| A. | 反应生成1mol N2时转移4mole- | |
| B. | 反应物能量之和大于生成物能量之和 | |
| C. | N2O(g)+NO(g)═N2(g)+NO2(g)△H=-139 kJ/mol | |
| D. | 断键吸收能量之和小于成键释放能量之和 |