题目内容
4.如图所示实验中,能够达到目的是( )| A | B | C | D |
 |  | 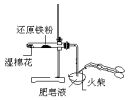 | 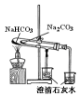 |
| 验证:溶解性AgCl>AgBr>Ag2S | 验证:非金属性Cl>C>Si | 验证:铁粉与水蒸气反应产生的氢气 | 验证:热稳定性 Na2CO3>NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.溶解度大的物质能转化为溶解度小的物质;
B.非金属的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸;
C.高温下,Fe和水蒸气反应生成四氧化三铁和氢气;
D.碳酸钠受热不易分解,碳酸氢钠受热易分解生成碳酸钠、水和二氧化碳.
解答 解:A.溶解度大的物质能转化为溶解度小的物质,该实验中AgCl转化为AgBr,AgBr能转化为Ag2S,沉淀颜色由白色转化为淡黄色、淡黄色转化为黑色,所以该实验能验证溶解性AgCl>AgBr>Ag2S,故A正确;
B.非金属的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,HCl不是Cl元素的最高价氧化物的水化物,且盐酸具有挥发性,生成的二氧化碳中含有HCl,影响碳酸酸性强弱的检验,所以该实验不能实现实验目的,故B错误;
C.高温下,Fe和水蒸气反应生成四氧化三铁和氢气,点燃肥皂泡验证氢气,该实验中没有加热条件,所以不能生成氢气,故C错误;
D.碳酸钠受热不易分解,碳酸氢钠受热易分解生成碳酸钠、水和二氧化碳,所以要验证热稳定性,碳酸钠的温度应该在大试管中、碳酸氢钠在小试管中,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,侧重考查学生实验操作能力,明确实验原理、物质性质是解本题关键,易错选项是B,注意二氧化碳中的HCl影响碳酸酸性检验,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.化学与生产和生活密切相关,下列有关说法正确的是( )
| A. | 硅太阳能电池利用的是原电池原理 | |
| B. | 用干燥的钢瓶盛装液氯和用铁制容器盛装容器盛装浓硝酸的原理相同 | |
| C. | 含有活性炭的口罩可阻挡雾霾,其原理是利用活性炭的吸附作用 | |
| D. | 用菜籽油浸泡花椒制得花椒油后,用分液的方法将花椒油分离出来 |
12.下列过程不涉及氧化还原反应的是( )
| A. | 钢铁腐蚀 | B. | 游泳池加漂白精消毒 | ||
| C. | 防毒面具中加Na2O2供氧 | D. | 纯碱去油污 |
19.下列物质放在空气中变质,且变质过程与空气中的O2、CO2、水蒸气都有关的是( )
| A. | 过氧化钠 | B. | 金属钠 | C. | 硫酸亚铁晶体 | D. | 亚硫酸钠 |
9.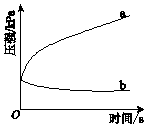 生铁在pH=2和pH=4的盐酸中发生腐蚀.在密闭容器中,用压强传感器记录该过程的压强变化,如图所示.下列说法中,不正确的是( )
生铁在pH=2和pH=4的盐酸中发生腐蚀.在密闭容器中,用压强传感器记录该过程的压强变化,如图所示.下列说法中,不正确的是( )
 生铁在pH=2和pH=4的盐酸中发生腐蚀.在密闭容器中,用压强传感器记录该过程的压强变化,如图所示.下列说法中,不正确的是( )
生铁在pH=2和pH=4的盐酸中发生腐蚀.在密闭容器中,用压强传感器记录该过程的压强变化,如图所示.下列说法中,不正确的是( )| A. | 两容器中负极反应均为Fe-2e-═Fe2+ | |
| B. | 曲线a记录的是pH=2的盐酸中压强的变化 | |
| C. | 曲线b记录的容器中正极反应是O2+4e-+2H2O═4OH- | |
| D. | 在弱酸性溶液中,生铁能发生吸氧腐蚀 |
16.设NA为阿伏伽德罗常数值.下列有关叙述正确的是( )
| A. | 30gC2H6中含有极性共价键的数目为6NA | |
| B. | 标准状况下,33.6LHF中含有氟原子的数目为1.5NA | |
| C. | 1mol氯气分别与铁和铝完全反应时转移的电子数均为3NA | |
| D. | 25℃,pH=7的NH4Cl和NH3•H2O的混合溶液中,含OH-的数目为10-7NA |
13.某化学兴趣小组设计实验探究Mg与盐溶液反应的多样性.
请回答下列问题:
(1)对实验I进行研究:
①推测实验Ⅰ中黑色固体为Ag,则发生反应的离子方程式为2Ag++Mg=2Ag+Mg2+.
②确认黑色固体为Ag的实验方案是将黑色固体过滤、洗涤,向其中加入稀HNO3,黑色固体溶解并产生无色气体,遇空气后变成红棕色,并向所得溶液中滴加NaCl溶液,生成白色沉淀.
(2)对实验II进行研究:
①反应开始时产生H2的原因可能是Mg和NH4+直接反应,或NH4+水解使溶液中c(H+)增大,与Mg反应生成H2.
②“一段时间后”产生的气体一定含有H2和NH3.
③为进一步研究,设计如下实验:
结合实验II、IV,可以得出的结论是Cl-有利于Mg和铵盐溶液反应产生H2(或SO42-不利于Mg和铵盐溶液反应产生H2、溶液中阴离子的种类会影响Mg和铵盐溶液反应产生H2).
(3)对实验III进行研究:
①经检验,白色固体为碱式碳酸镁[Mg2(OH)2CO3].
②推测在pH=8.2的该溶液中,若无HCO3-,则H+和Mg反应的程度很小.通过实验证实了该推测,其实验操作是向装有相同镁条的试管中加入2mLpH=8.2的NaOH溶液.
(4)根据上述实验判断,影响Mg与盐溶液反应多样性的原因有ACD(填字母序号)
A.盐溶液中阳离子的氧化性 B.盐溶液的温度
C.含Mg生成物的溶解性 D.盐溶液中阴离子的影响.
请回答下列问题:
| 实验 | 向试管中加2mL溶液 | 实验现象 |
 | 实验I:0.1 mol/L AgNO3溶液 | 镁条表面迅速覆盖一层疏松黑色固体,并有少量气泡产生 |
| 实验II:2.0 mol/L NH4Cl溶液 | 反应开始时产生大量气体(经检验其中含有H2),一段时间后产生使湿润的红色石蕊试纸变蓝的气体 | |
| 实验III:pH=8.2 NaHCO3溶液 | 产生大量气体(经检验其中含有H2和CO2)和白色固体 |
①推测实验Ⅰ中黑色固体为Ag,则发生反应的离子方程式为2Ag++Mg=2Ag+Mg2+.
②确认黑色固体为Ag的实验方案是将黑色固体过滤、洗涤,向其中加入稀HNO3,黑色固体溶解并产生无色气体,遇空气后变成红棕色,并向所得溶液中滴加NaCl溶液,生成白色沉淀.
(2)对实验II进行研究:
①反应开始时产生H2的原因可能是Mg和NH4+直接反应,或NH4+水解使溶液中c(H+)增大,与Mg反应生成H2.
②“一段时间后”产生的气体一定含有H2和NH3.
③为进一步研究,设计如下实验:
| 实验 | 操作 | 现象 |
| 实验IV | 向装有相同镁条的试管中加入2mL1.0mol/L (NH4)2SO4溶液 | 产生气体的速率明显慢于实验II |
(3)对实验III进行研究:
①经检验,白色固体为碱式碳酸镁[Mg2(OH)2CO3].
②推测在pH=8.2的该溶液中,若无HCO3-,则H+和Mg反应的程度很小.通过实验证实了该推测,其实验操作是向装有相同镁条的试管中加入2mLpH=8.2的NaOH溶液.
(4)根据上述实验判断,影响Mg与盐溶液反应多样性的原因有ACD(填字母序号)
A.盐溶液中阳离子的氧化性 B.盐溶液的温度
C.含Mg生成物的溶解性 D.盐溶液中阴离子的影响.
14.有机物命名正确的是( )
| A. | 1,3-二甲基丁烷 | B. | 2,3,5-三甲基己烷 | ||
| C. | 2,3-二甲基-2-乙基己烷 | D. | 2,3-二甲基-4-乙基戊烷 |