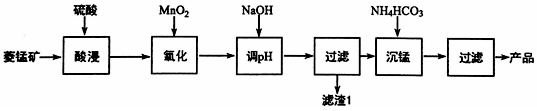
题目内容
8.YBa2Cu8Ox(Y为元素钇)是一种重要超导材料,下列关于${\;}_{39}^{89}$Y的说法错误的是( )| A. | 质量数是89 | B. | 质子数与中子数之差为50 | ||
| C. | 核外电子数是39 | D. | ${\;}_{39}^{89}$Y与${\;}_{39}^{90}$Y互为同位素 |
分析 原子中质子数、中子数、质量数之间的关系为质量数=质子数+中子数,原子中的质子数与电子数的关系为核电荷数=核外电子数=核内质子数,同位素是指质子数相同中子数不同的同种元素的不同原子互称同位素.
解答 解:A.原子符号左上角为质量数,所以钇原子质量数为89,故A正确;
B.质子数+中子数=质量数,中子数=质量数-质子数=89-39=50,质子数与中子数之差为50-39=11,故B错误;
C.原子的核外电子数=核内质子数,所以核外有39个电子,故C正确;
D.${\;}_{39}^{89}$Y与${\;}_{39}^{90}$Y质子数相同,质子数不同互为同位素,故D正确;
故选B.
点评 本题考查的是有关质子数、中子数、电子数之间的计算,以及同位素的定义,是小型综合题,属基础知识,题目难度不大.

练习册系列答案
相关题目
18.下列各组元素的电负性大小顺序正确的是( )
| A. | S<N<O<F | B. | S<O<N<F | C. | Si<Na<Mg<Al | D. | Br<H<Zn |
19.氮原子 2p 亚层上的 3 个电子不相同的是( )
| A. | 能量 | B. | 电子云形状 | C. | 电子云伸展方向 | D. | 自旋状态 |
2.用NA表示阿伏加德罗常数的值.下列判断错误的是( )
| A. | NA个H+的质量为1 g | |
| B. | 2 L 0.5 mol/L Na2SO4溶液中含NA个Na+ | |
| C. | 32 g O2中含有2NA个氧原子 | |
| D. | 标准状况下,1 mol H2O中含有NA个分子 |
9.将2mol X和2mol Y充入2L密闭容器中发生反应:X(g)+3Y(g)?2Z(g)+a Q(g).2min达到平衡时生成0.8mol Z,测得Q的浓度为0.4mol/L,下列叙述错误的是( )
| A. | Y的转化率为60% | B. | 反应速率v(Y)=0.3 mol/(L•min) | ||
| C. | a的值为2 | D. | 平衡时X的浓度为0.2 mol/L |
6.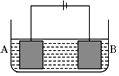 按如图所示的装置进行电解实验.A极是铜镍合金,B极为纯铜,电解质溶液为硫酸铜溶液(足量).通电一段时间后,A极恰好全部溶解,此时B极质量增加3.2g,溶液质量增加0.05g,(已知氧化性,Cu2+>Ni2+)则A合金中铜、镍原子个数比为( )
按如图所示的装置进行电解实验.A极是铜镍合金,B极为纯铜,电解质溶液为硫酸铜溶液(足量).通电一段时间后,A极恰好全部溶解,此时B极质量增加3.2g,溶液质量增加0.05g,(已知氧化性,Cu2+>Ni2+)则A合金中铜、镍原子个数比为( )
 按如图所示的装置进行电解实验.A极是铜镍合金,B极为纯铜,电解质溶液为硫酸铜溶液(足量).通电一段时间后,A极恰好全部溶解,此时B极质量增加3.2g,溶液质量增加0.05g,(已知氧化性,Cu2+>Ni2+)则A合金中铜、镍原子个数比为( )
按如图所示的装置进行电解实验.A极是铜镍合金,B极为纯铜,电解质溶液为硫酸铜溶液(足量).通电一段时间后,A极恰好全部溶解,此时B极质量增加3.2g,溶液质量增加0.05g,(已知氧化性,Cu2+>Ni2+)则A合金中铜、镍原子个数比为( )| A. | 4:1 | B. | 3:1 | C. | 2:1 | D. | 1:1 |
7.已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H
现在体积为1L的密闭容器中,充入CO2和H2.实验测得反应体系中物质的物质的量与时间关系如下表,
回答下列问题:
(1)表格中的n1=0.75mol
(2)0-5min内 v (H2)=0.3mol•L-1•min-1
(3)该条件下CO2的平衡转化率为75%.
现在体积为1L的密闭容器中,充入CO2和H2.实验测得反应体系中物质的物质的量与时间关系如下表,
| n(CO2) | n(H2) | n(CH3OH(g) | n(H2O(g) | |
| 0 | 1.00mol | 3.25mol | 0.00 | 0.00 |
| 5min | 0.50mol | 0.50mol | ||
| 10min | 0.25mol | 0.75mol | ||
| 15min | 0.25mol | n1 |
(1)表格中的n1=0.75mol
(2)0-5min内 v (H2)=0.3mol•L-1•min-1
(3)该条件下CO2的平衡转化率为75%.