题目内容
17. 从物质结构决定性质的视角可预测物质的有关性质.回答下列有关问题:
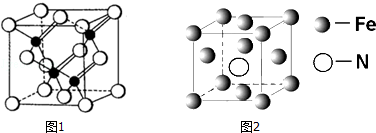
从物质结构决定性质的视角可预测物质的有关性质.回答下列有关问题:(1)金属钛(Ti)及钛的合金被认为是21世纪重要的金属材料,Ti的外围电子排布式为3d24s2;地壳中的钛矿石主要是以最高价氧化物形式存在的金红石,写出金红石的化学式:TiO2.
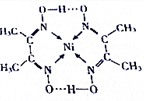
(2)镍(Ni)可形成复杂化合物,某镍的化合物结构如图所示,分子内含有的作用力有ACE(填序号).
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(3)(CH3)3N分子属于极性(填“极性”或“非极性”)分子.某物质由(CH3)3NH+和AlCl4-构成,熔点低于100℃,被称为离子液体,该离子液体既能溶解多种极性较弱的有机物,也能溶解多种极性较强的无机物.该离子液体的熔点低的原因是形成的离子键较弱.下列对该离子液体的说法中正确的是C(填序号).
A.该离子液体比较容易挥发,挥发时克服微粒间作用力是分子间作用力
B.该离子液体可作为某些实验中的萃取剂
C.该离子液体属于强极性溶剂,所以能溶解极性较强的无机物
D.AlCl4-中铝原子最外层未达8电子稳定结构.
分析 (1)Ti的质子数为22,其核外含有22个电子,根据核外电子排布规律可知其核外电子排布为:[Ar]3d24s2,Ti的最高价为+4价;
(2)根据配合物的结构图可判断键的类型;
(3)(CH3)3N分子可以看做是NH3中H原子被-CH3取代形成的化合物,结合氨气的空间构型分析,物质由(CH3)3NH+和AlCl4-构成,熔点低于100℃,熔点低的原因是形成的离子键作用小,
A.挥发克服的是阴阳离子间的作用力;
B.萃取剂需要满足和水溶液不溶,能分层,且物质溶解性在萃取剂中大于在水中的溶解性;
C.依据相似相溶的原理分析判断;
D.AlCl4-的价层电子对=4+$\frac{1}{2}$(3+1-4×1)=4,故Al采用sp3杂化.
解答 解:(1)Ti的质子数为22,其核外含有22个电子,根据核外电子排布规律可知其核外电子排布为:[Ar]3d24s2,所以其外围电子排布式为:3d24s2;Ti的价电子数为4,其最高价为+4价,则金红石的化学式为TiO2;
故答案为:3d24s2;TiO2;
(2)氧的电负性很强,与另外一个羟基形成氢键,配合物中含碳氧键、碳氢键、碳氮双建等共价键,氮镍间是配位键,不是离子键也不是金属键,分子内含有的作用力有ACE,
故答案为:ACE;
(3)(CH3)3N分子可以看做是NH3中H原子被-CH3取代形成的化合物,结构类似氨气的结构,氮原子连接三个甲基,氮原子有一对未成键电子的影响导致分子结构呈极性,属于极性分子,物质由(CH3)3NH+和AlCl4-构成,熔点低于100℃,离子液体中的作用力是离子键,熔点低是因为形成的离子键较弱易被破坏,该离子液体既能溶解多种极性较弱的有机物,也能溶解多种极性较强的无机物,尽管微弱但强于氢键和分子间作用力,所以其挥发性就小,
A.由(CH3)3NH+和AlCl4-构成,该离子液体比较容易挥发,挥发时克服微粒间作用力是阴阳离子间的静电作用力,故A错误;
B.该离子液体既能溶解多种极性较弱的有机物,也能溶解多种极性较强的无机物,不能分层形成萃取分液操作,所以该离子液体不可作为某些实验中的萃取剂,故B错误;
C.该离子液体是阴阳离子构成,属于离子化合物,属于强极性溶剂,相似相溶,所以能溶解极性较强的无机物,故C正确;
D.AlCl4-的价层电子对=4+$\frac{1}{2}$(3+1-4×1)=4,其中有一个配位键,AlCl4-中铝原子和氯原子形成四对共价键,最外层有四对成键电子,所以达到8电子稳定结构,故D错误;
故答案为:极性;形成的离子键较弱;C.
点评 本题考查了化学键、晶体类型等知识,原子结构、配合物结构、晶体结构和性质的分析判断,信息应用和理解、题干信息的分析是解题关键,题目难度中等.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案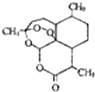 青蒿素是一种高效、速率搞疟药,是中医献给世界的一份礼物.其结构简式如图所示.下列有关青蒿素的说法正确的是( )
青蒿素是一种高效、速率搞疟药,是中医献给世界的一份礼物.其结构简式如图所示.下列有关青蒿素的说法正确的是( )| A. | 易溶于乙醚等有机溶剂 | B. | 分子式为C15H21O5 | ||
| C. | 能在热的NaOH溶液中存在 | D. | 分子结构中含有极性键 |
| A. | 能电离出H+的化合物都是酸,能电离出OH-的化合物都是碱 | |
| B. | 盐类物质一定含有金属离子 | |
| C. | NH3、CO2水溶液能够导电,所以NH3、CO2是电解质 | |
| D. | 可用丁达尔效应区别NaCl溶液和Fe(OH)3胶体 |
| A. | OH-的物质的量相同 | B. | H+ 物质的量浓度相同 | ||
| C. | OH-的物质的量浓度不同 | D. | H+的物质的量浓度不同 |
| A. | 把苯甲酸、甲醇、稀硫酸混合置于有回流设备的装置中,加热,合成苯甲酸甲酯 | |
| B. | 把苯和少量溴水及少量铁屑放在用带导管的瓶塞塞紧瓶口的烧瓶里,反应制取溴苯 | |
| C. | 把醋酸钠晶体(CH3COONa•3H2O)与干燥的碱石灰按一定比例混合后,加热,制取甲烷 | |
| D. | 把浓硝酸、浓硫酸、苯的混合液放在60℃的水浴中反应,制取硝基苯 |
| A. | 分别将它们配制成溶液,再加入澄清石灰水 | |
| B. | 分别将它们配制成溶液,再逐滴加入等浓度的稀盐酸 | |
| C. | 分别将它们配制成溶液,再加入CaCl2溶液 | |
| D. | 分别加热,再用石灰水检验是否有CO2产生 |
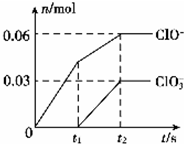 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与 反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与 反应时间(t)的变化示意图如图所示.下列说法不正确的是( )| A. | 反应中转移电子的物质的量是0.21mol | |
| B. | ClO3-的生成可能是由于温度升高引起的 | |
| C. | 苛性钾溶液中KOH的质量是16.8g | |
| D. | 一定有3.36L氯气参加反应 |
| A. | 往NaHC2O4溶液中通入氨气至中性:c(H2C2O4)+c(NH4+)>c(C2O42-) | |
| B. | 将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)变小 | |
| C. | 常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体后过滤,所得滤液中存在:c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| D. | 在同浓度的HCN和NaCN的混合溶液中,若pH>7,则c(HCN)<c(Na+) |