题目内容
18.钠、氯及其化合物有如下转化关系,请按要求填空: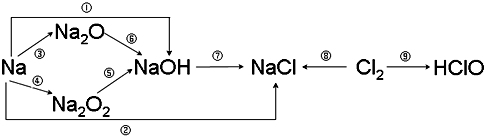
(1)金属钠投入水中,反应的离子方程式为.Na2O2可用于呼吸面具作氧气的来源,有关反应的化学方程式为2Na+2H2O=2Na++2OH-+H2↑、2Na2O2+2CO2=2Na2CO3+O2.
(2)上述9个转化关系中,属于化合反应但不属于氧化还原反应的是⑥(填写相应的序号).
(3)通常情况下,为了防止Cl2污染环境,在做完实验后,多余的氯气应用NaOH溶液吸收,其化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O.
(4)将新制氯水滴入AgNO3溶液中,可观察到有白色沉淀生成,原因是Ag++Cl-=AgCl↓(用离子方程式说明).将红色布条投到新制氯水中,可观察到布条红色褪去.
分析 (1)钠与水反应生成氢氧化钠和氢气;过氧化钠与二氧化碳反应生成碳酸钠和氧气;
(2)氧化还原反应必须有化合价变化;
(3)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;
(4)氯水中含有氯离子和次氯酸分子.
解答 解:(1)钠与水反应生成氢氧化钠和氢气,离子方程式:2Na+2H2O=2Na++2OH-+H2↑;过氧化钠与二氧化碳反应生成碳酸钠和氧气,化学方程式:2Na2O2+2CO2=2Na2CO3+O2;
故答案为:2Na+2H2O=2Na++2OH-+H2↑;2Na2O2+2CO2=2Na2CO3+O2;
(2)①钠与水反应生成氢氧化钠和氢气、②钠与盐酸反应生成氯化钠、③钠与氧气反应生成氧化钠、④钠与氧气反应生成过氧化钠、⑤过氧化钠与水反应生成氢氧化钠、⑦氢氧化钠和氯气反应生成氯化钠、次氯酸和水、⑧氯气与钠反应生成氯化钠、⑨氯气与水反应生成盐酸和次氯酸,都有化合价变化,属于氧化还原反应;
⑥氧化钠为碱性氧化物,与水化合生成氢氧化钠,属于化合反应,但是无化合价变化,不是氧化还原反应,
故选:⑥;
(3)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O;
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(4)氯水中含有氯离子和次氯酸分子,氯离子能够与硝酸银反应生成氯化银沉淀,离子方程式:Ag++Cl-=AgCl↓;次氯酸具有漂白性,能够使有色布条褪色;
故答案为:Ag++Cl-=AgCl↓;红色褪去.
点评 本题考查了钠及其化合物之间的转化,明确物质的性质是解题关键,注意氯水的成分及性质,题目难度不大.

练习册系列答案
相关题目
9.有两个无标签的试剂瓶,分别装有Na2CO3和NaHCO3固体,有四位同学为鉴别它们采用以下不同方法,其中不可行的是( )
| A. | 分别将它们配制成溶液,再加入澄清石灰水 | |
| B. | 分别将它们配制成溶液,再逐滴加入等浓度的稀盐酸 | |
| C. | 分别将它们配制成溶液,再加入CaCl2溶液 | |
| D. | 分别加热,再用石灰水检验是否有CO2产生 |
6.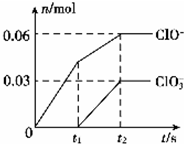 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与 反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与 反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与 反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与 反应时间(t)的变化示意图如图所示.下列说法不正确的是( )| A. | 反应中转移电子的物质的量是0.21mol | |
| B. | ClO3-的生成可能是由于温度升高引起的 | |
| C. | 苛性钾溶液中KOH的质量是16.8g | |
| D. | 一定有3.36L氯气参加反应 |
13.下列实验的现象与对应结论都正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 灼烧白色粉末,直接观察火焰颜色 | 火焰呈黄色 | 原粉末中有Na+无K+ |
| B | 将一块Al箔在酒精灯火焰上灼烧 | Al箔熔融而不滴落 | Al2O3具有较高的熔点 |
| C | 将一小块Na放入硫酸铜溶液中 | 有铜单质析出 | Na能置换出硫酸铜中的铜 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| A. | A | B. | B | C. | C | D. | D |
3.下列物质中能通过化合反应制取的是( )
①Fe3O4 ②Fe(OH)3 ③FeCl2 ④FeCl3.
①Fe3O4 ②Fe(OH)3 ③FeCl2 ④FeCl3.
| A. | ①④ | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
10.干冰不能用来扑灭镁条火灾,反应为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,该反应属于( )
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
7.下列说法正确的是( )
| A. | 往NaHC2O4溶液中通入氨气至中性:c(H2C2O4)+c(NH4+)>c(C2O42-) | |
| B. | 将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)变小 | |
| C. | 常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体后过滤,所得滤液中存在:c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| D. | 在同浓度的HCN和NaCN的混合溶液中,若pH>7,则c(HCN)<c(Na+) |