题目内容
20.已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍.现以A为主要原料合成F,其合成路线如图1所示.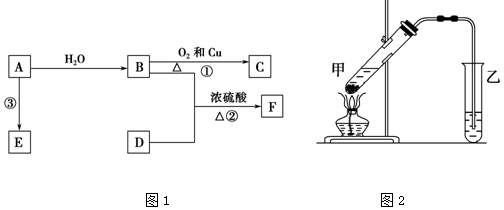
(1)A的结构式为CH2=CH2,B中决定性质的重要官能团的名称为羟基.
(2)写出反应的化学方程式并判断反应类型.
①2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,反应类型:氧化反应.
②CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,反应类型:酯化反应.
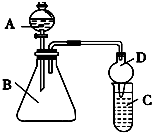
(3)在实验室里我们可以用如图2所示的装置来制取F,反应中浓硫酸的作用催化剂和吸水剂.该装置中有一个明显的错误乙中导管在液面下.
分析 A的产量通常用来衡量一个国家的石油化工水平,A应为乙烯,其结构简式为CH2=CH2,乙烯和水在催化剂条件下发生加成反应生成B为CH3CH2OH,乙醇被催化氧化生成C为CH3CHO,F是一种有香味的物质,F中碳原子数是D的两倍,可知D为CH3COOH,乙醇和乙酸在浓硫酸作用下反应生成F为CH3COOCH2CH3,反应③为乙烯的加聚反应 ,E应为聚乙烯,以此来解答.
,E应为聚乙烯,以此来解答.
解答 解:(1)由上述分析可知,A的结构简式为CH2=CH2,B为乙醇,官能团名称为羟基,
故答案为:CH2=CH2;羟基;
(2)①B为乙醇,乙醇被催化氧化生成乙醛,反应的化学方程式为2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,反应类型为氧化反应,
②乙醇和乙酸在浓硫酸作用下发生酯化反应生成乙酸乙酯,反应的方程式为CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,属于酯化反应或取代反应,
故答案为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O;氧化反应;CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O;酯化反应;
(3)酯化反应中浓硫酸作催化剂,且作吸水剂,使平衡正向移动,利用合成乙酸乙酯,由图可知,乙中导管在液面下可发生倒吸,
故答案为:催化剂;吸水剂;乙中导管在液面下.
点评 本题考查有机物的合成,为高频考点,把握合成流程中官能团的变化、有机反应为解答的关键,侧重分析与应用能力的考查,注意乙酸乙酯的制备实验,题目难度不大.

练习册系列答案
相关题目
16.关于金属钠单质及其化合物的说法中,不正确的是( )
| A. | NaCl可用作食品调味剂 | |
| B. | 相同温度下NaHCO3溶解度大于Na2CO3 | |
| C. | Na2CO3的焰色反应呈黄色 | |
| D. | 工业上Na可用于制备钛、锆等金属 |
8.“环境保护”意识深入人心,下列关于酸雨的认识中错误的是( )
| A. | .正常条件下,pH值小于5.6的降雨是“酸雨” | |
| B. | 冰岛火山喷发含有大量SO2,在局部区域形成酸雨 | |
| C. | 全球“低碳”行动能减少CO2排放量,也就能降低酸雨的形成及危害 | |
| D. | 汽车尾气含有氮氧化合物,过量排放形成酸雨 |
12.温度700℃时,向容积为1L的密闭容器中充入一定量的CO和H2O发生反应CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t1<t2).下列说法正确的是( )
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 0.60 | 0.30 |
| t1 | 0.40 | |
| t2 | 0.10 |
| A. | 反应在t1min内的平均速率为v(H2)=0.20/t1mol•L-1•min-1 | |
| B. | 保持其他条件不变,向平衡体系中再通入0.10molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小 | |
| C. | 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 | |
| D. | 700℃时,若向密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为0.60mol、1.00mol、0.60mol、0.60mol,则此时该反应v(正)<v(逆) |
10.下列说法正确的是( )
| A. | 常温下用二氧化锰和浓盐酸反应制取Cl2 | |
| B. | 用饱和氯化钠溶液可以洗涤除去氯化钠固体表面少量氯化钾杂质 | |
| C. | 向某溶液中加入盐酸酸化的BaCl2溶液,产生白色沉淀,可知该溶液中一定含有SO42- | |
| D. | 向浓度均为0.01mol/L的K2SO4和KI混合溶液中滴加Pb(NO3)2溶液,先生成PbI2黄色沉淀 |
 某同学为探究元素周期表中元素性质的递变规律,设计了如下实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下实验.
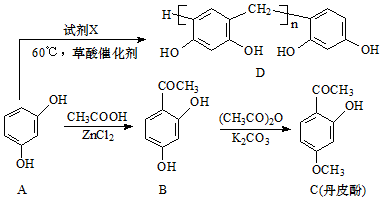
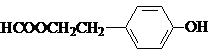 (写结构简式).
(写结构简式).