题目内容
18.分子式为C4H10O的有机物,能与钠反应放出H2的有( )种.| A. | 4 | B. | 6 | C. | 7 | D. | 8 |
分析 分子式为C4H10O的有机物,能与金属钠反应放出氢气,说明分子中含有-OH,该物质为丁醇,书写丁基-C4H9异构,丁基异构数目等于丁醇的异构体数目,可由醛还原而成的醇与羟基相连的碳上有2个氢原子.
解答 解:分子式为C4H10O的有机物,能与金属钠反应放出氢气,说明分子中含有-OH,该物质为丁醇,丁基-C4H9可能的结构有:-CH2CH2CH2CH3、-CH(CH3)CH2CH3、-CH2CH(CH3)2、-C(CH3)3,所以该有机物的可能结构有4种.
故选A.
点评 本题考查了同分异构体的书写等,难度中等,利用烃基异构判断,比书写丁醇的同分异构体简单容易,侧重于考查学生的分析能力.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
1.在实验室中,对下列事故或药品的处理正确的是( )
| A. | 金属钠失火时立即用水灭火,然后用稀硫酸中和 | |
| B. | 为了防止挥发,氢氧化钠溶液保存在用磨砂玻璃塞的玻璃试剂瓶中 | |
| C. | 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 | |
| D. | 配置一定物质的量浓度溶液时,不慎将少量水加过刻度线,应重新配置 |
9.如图表示初中化学常见实验操作,其中正确的是( )
| A. |  点燃酒精灯 | B. |  检查装置的气密性 | ||
| C. |  读出液体的体积 | D. |  液体的取用 |
13.下列现象描述错误的是( )
| A. | 氯气与紫色石蕊溶液--先变红后褪色 | |
| B. | 过量的Cl2与KI淀粉溶液--变蓝 | |
| C. | SO2与紫色石蕊溶液--变红 | |
| D. | 硫化氢与湿润的醋酸铅试纸--变黑 |
10.实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收铜并制备ZnO的部分实验过程如图:
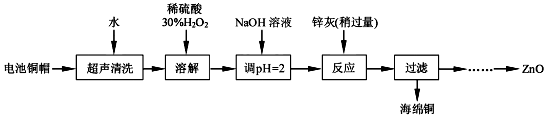
(1)①写出铜帽溶解过程中铜发生反应的化学方程式Cu+H2O2+H2SO4=CuSO4+2H2O.
②铜帽溶解后需将溶液中过量H2O2除去.除去H2O2的简便方法是加热(至沸腾).
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH至3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点.上述过程中的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 I2+2S2O32-=2I-+S4O62-
①滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象为溶液蓝色褪去,且半分钟内不恢复.
②若滴定前溶液中H2O2没有除尽,所测得的Cu2+的含量将会偏高(填“偏高”、“偏低”、“不变”).
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)
实验中可选用的试剂:30% H2O2、1.0mol•L-1HNO3、1.0mol•L-1 NaOH.
由回收铜后的滤液制备ZnO的实验步骤依次为:
①向滤液中加入略过量30%的H2O2,使其充分反应
②向反应后的溶液中滴加1.0moL•L-1的NaOH溶液,调节溶液的pH
范围为3.2~5.9;
③过滤;
④向滤液中滴加1.0moL•L-1的氢氧化钠,调节pH范围为8.9~11;
⑤过滤、洗涤、干燥
⑥900℃煅烧.

(1)①写出铜帽溶解过程中铜发生反应的化学方程式Cu+H2O2+H2SO4=CuSO4+2H2O.
②铜帽溶解后需将溶液中过量H2O2除去.除去H2O2的简便方法是加热(至沸腾).
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH至3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点.上述过程中的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 I2+2S2O32-=2I-+S4O62-
①滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象为溶液蓝色褪去,且半分钟内不恢复.
②若滴定前溶液中H2O2没有除尽,所测得的Cu2+的含量将会偏高(填“偏高”、“偏低”、“不变”).
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 完全沉淀的pH | 3.2 | 8.8 | 8.9 |
由回收铜后的滤液制备ZnO的实验步骤依次为:
①向滤液中加入略过量30%的H2O2,使其充分反应
②向反应后的溶液中滴加1.0moL•L-1的NaOH溶液,调节溶液的pH
范围为3.2~5.9;
③过滤;
④向滤液中滴加1.0moL•L-1的氢氧化钠,调节pH范围为8.9~11;
⑤过滤、洗涤、干燥
⑥900℃煅烧.
7.已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.在相同温度下,相同容积的恒容容器中,实验测得起始、平衡时的有关数据如表:则下列关系中正确的是( )
| 实验 编号 | 起始时各物质的物质的量/mol | 达到平衡时体系的变化 | 平衡时NH3的体积分数 | ||
| N2 | H2 | NH3 | |||
| ① | 1 | 3 | 0 | 放出热量:23.15 kJ | W1 |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q kJ | W2 |
| A. | W1>W2,Q<23.15 | B. | W1=W2,Q=23.15 | C. | W1<W2,Q>23.15 | D. | W1=W2,Q<23.15 |
8.在一定条件下发生反应3A(g)+2B(g)?xC(g)+2D(g),在2L 的密闭容器中把 4mol A 和 2mol B 混合,2min 后反应达到平衡时生成 1.6mol C,又测得反应速率v(D)=0.2mol•(L•min)-1.则下列说法不正确的是( )
| A. | x=4 | |
| B. | 平衡时气体压强是原来压强的1.1倍 | |
| C. | A的平衡浓度是1.4 mol•L-1 | |
| D. | B的转化率是40% |
 .
. )的一元取代物;②存在羟甲基(-CH2OH).写出W所有可能的结构简式
)的一元取代物;②存在羟甲基(-CH2OH).写出W所有可能的结构简式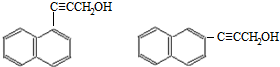 .
.