题目内容
7.已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.在相同温度下,相同容积的恒容容器中,实验测得起始、平衡时的有关数据如表:则下列关系中正确的是( )| 实验 编号 | 起始时各物质的物质的量/mol | 达到平衡时体系的变化 | 平衡时NH3的体积分数 | ||
| N2 | H2 | NH3 | |||
| ① | 1 | 3 | 0 | 放出热量:23.15 kJ | W1 |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q kJ | W2 |
| A. | W1>W2,Q<23.15 | B. | W1=W2,Q=23.15 | C. | W1<W2,Q>23.15 | D. | W1=W2,Q<23.15 |
分析 ②中反应物起始状态可完全转化为生成物时和①完全相同,所以①②是等效平衡,根据①中放出的热量,可以计算出平衡状态时各物质的量,再,再根据②中起始状态,判断②达到平衡时变化的N2的量,计算出反应放出的热量QkJ的量,由此判断解答.
解答 解:②中反应物完全转化为生成物时和①相同,所以①②是等效平衡,达到平衡时平衡状态完全相同,平衡时NH3的体积分数相同,即W1=W2,
①平衡时放出的热量为23.15 kJ,根据N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,可知变化的N2的物质的量为1mol×(23.15 kJ÷92.4kJ)=0.25mol,可知平衡时N2的物质的量为1mol-0.25mol=0.75mol,可知②中N2的变化量为0.9mol-0.75mol=0.15mol,变化量小于①中N2的变化量,放出的热量Q小于23.15 kJ,选项D符合题意,故答案为:D.
点评 本题考查化学平衡有关计算,侧重考查分析、计算能力,注意①②为等效平衡,难点是①②等效平衡的构建和根据能量变化计算变化的N2的物质的量,题目难度中等,注重基础考查.

练习册系列答案
相关题目
18.分子式为C4H10O的有机物,能与钠反应放出H2的有( )种.
| A. | 4 | B. | 6 | C. | 7 | D. | 8 |
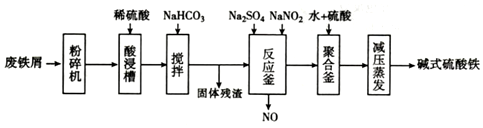
15.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型髙效絮凝剂,在医药上也可于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的流程如图:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
回答下列问题:
(1)粉碎过筛的目的是选取细小颗粒,增大反应接触面积,提高“酸浸”反应速率.
(2)加入少量NaHCO3的目的是调节溶液pH,使溶液中的Al3+完全沉淀.
(3)反应釜中发生反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.在实际生产中,常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于约NaNO2的物质的量为2mol.
(4)聚合釜中溶液的pH必须控制在一定的范围内.pH偏小时Fe3+水解程度弱,PH偏大时则形成Fe(OH)3沉淀.
(5)相对于常压蒸发,减压蒸发的优点是减压蒸发,可防止温度过高,碱式硫酸铁分解.

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)粉碎过筛的目的是选取细小颗粒,增大反应接触面积,提高“酸浸”反应速率.
(2)加入少量NaHCO3的目的是调节溶液pH,使溶液中的Al3+完全沉淀.
(3)反应釜中发生反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.在实际生产中,常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于约NaNO2的物质的量为2mol.
(4)聚合釜中溶液的pH必须控制在一定的范围内.pH偏小时Fe3+水解程度弱,PH偏大时则形成Fe(OH)3沉淀.
(5)相对于常压蒸发,减压蒸发的优点是减压蒸发,可防止温度过高,碱式硫酸铁分解.
2.下列各组中的两种物质互为同分异构体的是( )
| A. | 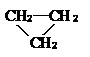 和CH3CH=CH2 和CH3CH=CH2 | B. | 淀粉和纤维素 | ||
| C. | CH3CH2CH2CH3和CH3CH2CH3 | D. | 乙烷和乙酸 |
19.已知化学反应A2(g)+B2(g)═2AB(s)的能量变化如图所示,判断下列叙述中错误的是( )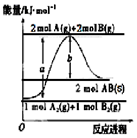

| A. | 该反应热△H=+(a-b)kJ•mol-1 | |
| B. | AB(g)═A(g)+B(g)△H=+b/2kJ•mol-1 | |
| C. | 断裂1 mol A-A键和1 mol B-B键,吸收a kJ能量 | |
| D. | 该反应在任何条件下都不可能自发进行 |
16.设NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 4.6g金属钠与足量O2充分反应后,所得固体中阴、阳离子的总数为0.3NA | |
| B. | 1L 0.5 mol/L的FeCl3溶液充分水解后,所得Fe(OH)3胶粒的数目小于0.5NA | |
| C. | 2.0g H218O与D2O的混合物中所含中子数为NA | |
| D. | 1L含NA个Al3+的Al(NO3)3液中,NO3-物质的量浓度为3 mol/L |
17.下列各组离子在指定溶液中能大量共存的是( )
| A. | 酸性溶液中:NH4+、Ba2+、AlO2-、Cl- | |
| B. | 滴入酚酞显红色的溶液中:Na+、K+、SiO32-、HCO3- | |
| C. | 滴入石蕊显红色的溶液中:K+、Ca2+、Fe2+、NO3- | |
| D. | 澄清透明溶液中:K+、MnO4-、H3O+、SO42- |
 有关物质的转化关系如图所示,固体X由两种常见元素组成,其中一种为常见金属元素,另一种为非金属元素,且质量比为14:1,B是常见的无色无味气体,可以使澄清石灰水变浑浊,C是一种红棕色气体,D是最常见的无色液体,E溶液遇硫氰化钾溶液显血红色,F是紫红色的金属单质,I是常见的无色气体,遇空气变为红棕色.
有关物质的转化关系如图所示,固体X由两种常见元素组成,其中一种为常见金属元素,另一种为非金属元素,且质量比为14:1,B是常见的无色无味气体,可以使澄清石灰水变浑浊,C是一种红棕色气体,D是最常见的无色液体,E溶液遇硫氰化钾溶液显血红色,F是紫红色的金属单质,I是常见的无色气体,遇空气变为红棕色. 
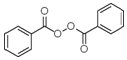 也被禁用. 下面是一种以苯为原料合成过氧化苯甲酰的流程:
也被禁用. 下面是一种以苯为原料合成过氧化苯甲酰的流程: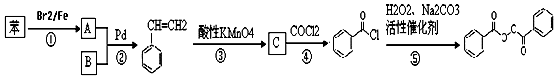
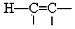 $\stackrel{Pd}{→}$
$\stackrel{Pd}{→}$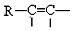
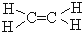 ;
;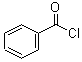 +H2O2$\frac{\underline{\;催化剂\;}}{碳酸钠}$
+H2O2$\frac{\underline{\;催化剂\;}}{碳酸钠}$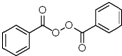 +2HCl;
+2HCl;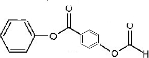 、
、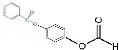 ;
; ;
; 的流程,无机物任选,注明反应条件.
的流程,无机物任选,注明反应条件.