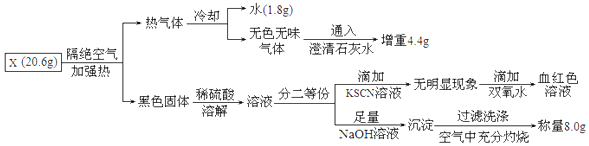
题目内容
17.设NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 1个甲烷(CH4)分子中有4个C-H键 | |
| B. | 同温、同压下,相同体积的氟气和氢气所含的原子数相等 | |
| C. | 标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA | |
| D. | 在含2molH2SO4的浓H2SO4溶液中加入足量的Zn粉,使其充分反应,则反应结束时转移电子数共4NA(Zn+2H2SO4(浓)→ZnSO4+SO2↑+H2O) |
分析 A.甲烷分子中含有4个碳氢键;
B.同温同压下,相同体积的气体具有相同的物质的量,氢气和氟气都是双原子分子;
C.根据n=$\frac{V}{{V}_{m}}$计算出混合气体的物质的量,结合二者都是双原子分子计算含有的原子数;
D.Zn与浓硫酸反应的化学方程式为Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,锌与稀硫酸的反应为Zn+H2SO4=ZnSO4+H2↑,结合反应方程式计算.
解答 解:A.甲烷为正四面体结构,1个甲烷(CH4)分子中有4个C-H键,故A正确;
B.同温、同压下,相同体积的氟气和氢气具有相同的物质的量,二者都是双原子分子,则二者所含的原子数相等,故B正确;
C.标准状况下,11.2L以任意比例混合的氮气和氧气的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,0.5mol混合气体中含有1mol原子,含有原子的数目为NA,故C正确;
D.含2molH2SO4的浓H2SO4溶液中加入足量的Zn粉,使其充分反应,反应Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O中2mol硫酸完全反应转移2mol电子,反应Zn+H2SO4=ZnSO4+H2↑中消耗2mol硫酸转移4mol电子,所以最终反应转移电子的物质的量小于4mol,故D错误;
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
8.下列热化学方程式正确的是( )
| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 已知2SO2(g)+O2(g)?2SO3(g)△H=-196.64kJ•mol-1,在容器中充入1mol SO2和0.5mol O2充分反应,放出的热量为98.32KJ | |
| C. | 已知在120C、101kPa时,1gH2燃烧生成水蒸气放出121KJ,其热化学方程式表示为H2(g)+$\frac{1}{2}$O2(g)=2H2O(l)△H=-242KJ/mol | |
| D. | CO(g) 的燃烧热是283.0kJ•mol-1,则CO2(g)=CO(g)+$\frac{1}{2}$O2(g)△H=+283kJ/mol |
5.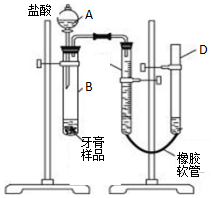 某研究性学习小组对同学们常用的三种品牌牙膏中摩擦剂成分进行调查,结果如表:
某研究性学习小组对同学们常用的三种品牌牙膏中摩擦剂成分进行调查,结果如表:
(1)某品牌透明牙膏的摩擦剂二氧化硅属于酸性(填酸性、碱性或两性)氧化物,其常作为工业制备晶体硅的原料,其反应原理是SiO2+2C$\frac{\underline{\;\;△\;\;}}{\;}$ Si+2CO↑(用化学反应方程式表示).
(2)某品牌儿童牙膏中摩擦剂成分与NaOH溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
(3)该小组同学拟用如图装置进一步测定某品牌药物牙膏中碳酸钙的含量(牙膏中其它成分遇到C盐酸时无气体生成).试回答下列问题:
①描述实验开始后C、D中的现象:C中液面逐渐降低,D中液面逐渐升高;
②C中所装液体最佳的是c;
a.饱和食盐水 b.蒸馏水c.饱和碳酸氢钠溶液 d.饱和碳酸钠溶液
③B中反应停止后需记录C中液面的读数,读数时应注意:
a.待容器冷却至室温;
b.调节仪器D的高度,使C、D液面相平;
c.读数时视线要平视液面.
④若实验开始所用牙膏样品质量为m g,测得反应产生气体体积为V mL(已经换算为标准状况),则该牙膏样品中碳酸钙的质量分数为$\frac{100V}{224m}%$.
 某研究性学习小组对同学们常用的三种品牌牙膏中摩擦剂成分进行调查,结果如表:
某研究性学习小组对同学们常用的三种品牌牙膏中摩擦剂成分进行调查,结果如表:| 某品牌药物牙膏 | 某品牌儿童牙膏 | 某品牌透明牙膏 | |
| 摩擦剂 | 碳酸钙 | 氢氧化铝 | 二氧化硅 |
(2)某品牌儿童牙膏中摩擦剂成分与NaOH溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
(3)该小组同学拟用如图装置进一步测定某品牌药物牙膏中碳酸钙的含量(牙膏中其它成分遇到C盐酸时无气体生成).试回答下列问题:
①描述实验开始后C、D中的现象:C中液面逐渐降低,D中液面逐渐升高;
②C中所装液体最佳的是c;
a.饱和食盐水 b.蒸馏水c.饱和碳酸氢钠溶液 d.饱和碳酸钠溶液
③B中反应停止后需记录C中液面的读数,读数时应注意:
a.待容器冷却至室温;
b.调节仪器D的高度,使C、D液面相平;
c.读数时视线要平视液面.
④若实验开始所用牙膏样品质量为m g,测得反应产生气体体积为V mL(已经换算为标准状况),则该牙膏样品中碳酸钙的质量分数为$\frac{100V}{224m}%$.
2.下列各组溶液中,可用溴水做试剂将其鉴别出来的是( )
| A. | 汽油、酒精、NaCl溶液 | B. | 汽油、四氯化碳、水 | ||
| C. | 汽油、酒精、NaOH溶液 | D. | 汽油、苯、NaOH溶液 |
9.等物质的量的O2、N2、CO2混合气体通过Na2O2后,体积变为原体积的$\frac{8}{9}$(同温同压),这时混合气体中O2、N2、CO2物质的量之比为( )
| A. | 9:6:0 | B. | 4:3:1 | C. | 3:3:2 | D. | 7:6:3 |
6.下列离子方程式书写正确的是( )
| A. | 稀硫酸与氧化铜反应:O2-+2H+═H2O | |
| B. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 碳酸钡与盐酸反应:BaCO3+2H+═Ba2++CO2↑+H2O | |
| D. | 向氯化钙溶液中通入CO2:Ca2++H2O+CO2═CaCO3↓+2H+ |
7.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )
| A. | 氯水的颜色呈黄绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ | |
| D. | 向NaBr溶液中滴加氯水,溶液颜色变成黄色,说明氯水中含有HClO |