题目内容
9.等物质的量的O2、N2、CO2混合气体通过Na2O2后,体积变为原体积的$\frac{8}{9}$(同温同压),这时混合气体中O2、N2、CO2物质的量之比为( )| A. | 9:6:0 | B. | 4:3:1 | C. | 3:3:2 | D. | 7:6:3 |
分析 氧气和氮气都不和过氧化钠反应,二氧化碳和过氧化钠反应生成氧气,根据反应前后体积的变化判断出二氧化碳有剩余,再根据反应的化学方程式计算混合气体中N2、O2、CO2物质的量之比.
解答 解:设三者的物质的量分别为3mol,发生的反应方程式为2Na2O2+2CO2=2Na2CO3+O2,现气体体积变为原来的$\frac{8}{9}$,即剩余气体的物质的量为8mol,若二氧化碳完全与过氧化钠反应,则气体的物质的量减少1.5 mol,即剩余气体为7.5 mol,说明二氧化碳有剩余,设有xmol二氧化碳参加反应,则有3+3+0.5x+(3-x)=8,解得:x=2,所以反应后N2的物质的量为3mol,O2的物质的量为4mol,CO2的物质的量为1mol,反应后的混合气体中O2、N2、CO2物质的量之比为4:3:1,
故选B.
点评 本题考查有关混合物的计算,题目难度不大,注意明确通过过氧化钠时,因为二氧化碳变为氧气,引起体积变化,注意差量法在化学计算中的应用方法,试题有利于培养学生的分析、理解能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列自然、生活中的事例不属于氧化还原反应的是( )
| A. | 食物腐败 | B. | 植物光合作用 | C. | 金属生锈 | D. | 石膏点制豆腐 |
17.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1个甲烷(CH4)分子中有4个C-H键 | |
| B. | 同温、同压下,相同体积的氟气和氢气所含的原子数相等 | |
| C. | 标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA | |
| D. | 在含2molH2SO4的浓H2SO4溶液中加入足量的Zn粉,使其充分反应,则反应结束时转移电子数共4NA(Zn+2H2SO4(浓)→ZnSO4+SO2↑+H2O) |
4.下列电离方程式书写正确的是( )
| A. | H2SO4→2H++SO42 | B. | Ba(OH)2→Ba2++(OH)2 | ||
| C. | FeCl3→Fe2++3Cl- | D. | NaHCO3→Na++H++CO32- |
14.下表是几种弱酸常温下的电离平衡常数:
则下列说法中不正确的是( )
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
| A. | 碳酸的酸性强于氢硫酸 | |
| B. | 多元弱酸的酸性主要由第一步电离决定 | |
| C. | 常温下,加水稀释醋酸,$\frac{c(C{H}_{3}CO{O}^{-})}{c(CHCOOH)•c(O{H}^{-})}$增大 | |
| D. | 向弱酸溶液中加少量NaOH溶液,电离常数不变 |
18.能正确表示下列化学反应的离子方程式是( )
| A. | 氢氧化钡溶液与硫酸的反应 OH-+H+═H2O | |
| B. | 将钠投入到硫酸铜溶液中发生的反应:2Na+Cu2+=2Na++Cu | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | 碳酸钙溶于稀盐酸中 CaCO3+2H+═Ca2++H2O+CO2↑ |
19.下列有关化学用语表示正确的是( )
| A. | NF3的电子式: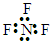 | B. | F-的结构示意图: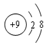 | ||
| C. | 中子数为18的硫原子:${\;}_{16}^{18}$S | D. | 乙酸甲酯的结构简式:HCOOCH2CH3 |
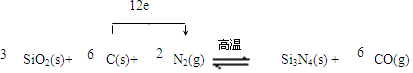 .
.