题目内容
5. 某研究性学习小组对同学们常用的三种品牌牙膏中摩擦剂成分进行调查,结果如表:
某研究性学习小组对同学们常用的三种品牌牙膏中摩擦剂成分进行调查,结果如表:| 某品牌药物牙膏 | 某品牌儿童牙膏 | 某品牌透明牙膏 | |
| 摩擦剂 | 碳酸钙 | 氢氧化铝 | 二氧化硅 |
(2)某品牌儿童牙膏中摩擦剂成分与NaOH溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
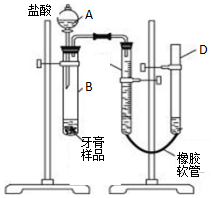
(3)该小组同学拟用如图装置进一步测定某品牌药物牙膏中碳酸钙的含量(牙膏中其它成分遇到C盐酸时无气体生成).试回答下列问题:
①描述实验开始后C、D中的现象:C中液面逐渐降低,D中液面逐渐升高;
②C中所装液体最佳的是c;
a.饱和食盐水 b.蒸馏水c.饱和碳酸氢钠溶液 d.饱和碳酸钠溶液
③B中反应停止后需记录C中液面的读数,读数时应注意:
a.待容器冷却至室温;
b.调节仪器D的高度,使C、D液面相平;
c.读数时视线要平视液面.
④若实验开始所用牙膏样品质量为m g,测得反应产生气体体积为V mL(已经换算为标准状况),则该牙膏样品中碳酸钙的质量分数为$\frac{100V}{224m}%$.
分析 (1)二氧化硅和碱反应生成盐和水,属于酸性氧化物;二氧化硅和碳在高温下反应生成硅和一氧化碳;
(2)氢氧化铝与NaOH溶液反应生成偏铝酸钠和水;
(3)①装置中A中盐酸滴入试管B中反应生成二氧化碳C中液面下降,D中液面上升;
②C中所装液体不能和二氧化碳反应,不能溶解二氧化碳减少二氧化碳的损失,测定结果更准确;
③C是量气管,测量气体体积需要冷却至室温,调节仪器D的高度,使C、D液面相平,读数时视线要平视液面等;
④若实验开始所用牙膏样品质量为m g,测得反应产生气体体积为V mL(已经换算为标准状况),依据元素守恒计算;
解答 解:(1)某品牌透明牙膏的摩擦剂二氧化硅属于酸性氧化物,二氧化硅作为工业制备晶体硅的原料高温下和焦炭反应生成硅和一氧化碳,反应的化学方程式为:SiO2+2C$\frac{\underline{\;\;△\;\;}}{\;}$ Si+2CO↑,
故答案为:酸性; SiO2+2C$\frac{\underline{\;\;△\;\;}}{\;}$ Si+2CO↑;
(2)某品牌儿童牙膏中摩擦剂成分是氢氧化铝与NaOH溶液反应生成偏铝酸钠和水,反应的离子方程式是:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)①装置中A中盐酸滴入试管B中反应生成二氧化碳,C中液面下降,D中液面上升,
故答案为:C中液面逐渐降低,D中液面逐渐升高;
②C中所装液体不能和二氧化碳反应,不能溶解二氧化碳减少二氧化碳的损失,测定结果更准确,
a.饱和食盐水会溶解二氧化碳,故a错误;
b.蒸馏水会溶解二氧化碳使测定气体体积减小,故|b错误;
c.饱和碳酸氢钠溶液会减小二氧化碳溶解,测定结果更准确,故c准确;
d.饱和碳酸钠溶液会和二氧化碳反应生成碳酸氢钠,二氧化碳气体损失,故d错误;
故答案为:c;
③C是量气管,测量气体体积需要冷却至室温,调节仪器D的高度,使C、D液面相平,读数时视线要平视液面等,B中反应停止后需记录C中液面的读数,读数时应注意:
a.待容器冷却至室温;
b.调节仪器D的高度,使C、D液面相平;
c.读数时视线要平视液面,
故答案为:调节仪器D的高度,使C、D液面相平;
④若实验开始所用牙膏样品质量为m g,测得反应产生气体体积为V mL(已经换算为标准状况),依据碳元素守恒计算,碳酸钙和二氧化碳物质的量相同,
牙膏样品中碳酸钙的质量分数=$\frac{\frac{V×1{0}^{-3}L}{22.4L/mol}×100g/mol}{mg}$×100%=$\frac{100V}{224m}%$,
故答案为:$\frac{100V}{224m}%$;
点评 本题考查了物质组成和实验探究方法、实验过程分析判断、物质性质和反应现象等,掌握基础是解题关键,题目难度中等.

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案| A. | 氯气和液氯是两种不同的物质 | |
| B. | 可以用浓硫酸除去氯气中的水蒸气 | |
| C. | 氯气是一种有毒气体,但可用于自来水的杀菌消毒 | |
| D. | 尽管氯气的化学性质很活泼,但是纯净的液氯能用钢瓶贮存 |
| A. |  | B. |  | C. |  | D. |  |
| A. | 1个甲烷(CH4)分子中有4个C-H键 | |
| B. | 同温、同压下,相同体积的氟气和氢气所含的原子数相等 | |
| C. | 标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA | |
| D. | 在含2molH2SO4的浓H2SO4溶液中加入足量的Zn粉,使其充分反应,则反应结束时转移电子数共4NA(Zn+2H2SO4(浓)→ZnSO4+SO2↑+H2O) |
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
| A. | 碳酸的酸性强于氢硫酸 | |
| B. | 多元弱酸的酸性主要由第一步电离决定 | |
| C. | 常温下,加水稀释醋酸,$\frac{c(C{H}_{3}CO{O}^{-})}{c(CHCOOH)•c(O{H}^{-})}$增大 | |
| D. | 向弱酸溶液中加少量NaOH溶液,电离常数不变 |
| A. | 中和滴定实验中,盛放NaOH溶液的锥形瓶用NaOH溶液润洗 | |
| B. | 进行滴定操作时,眼睛应注视滴定管中液面的变化 | |
| C. | 用pH试纸测量未知溶液的pH时,先用蒸馏水润湿pH试纸 | |
| D. | 在中和反应反应热的测定中,测量完盐酸温度的温度计用水洗净后再测量NaOH溶液的温度 |

 ;
;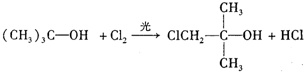 ,反应类型:取代反应;
,反应类型:取代反应; .
.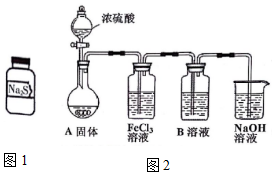 有两瓶标签已被腐蚀的药品,只看到“Na2S”字样(如图1),每瓶药品可能是Na2S、Na2SO3、Na2S2O3、Na2SiO3、Na2SO4中的一种.将两瓶药品分别标记为A、B,
有两瓶标签已被腐蚀的药品,只看到“Na2S”字样(如图1),每瓶药品可能是Na2S、Na2SO3、Na2S2O3、Na2SiO3、Na2SO4中的一种.将两瓶药品分别标记为A、B,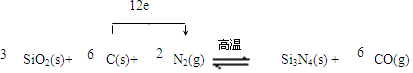 .
.