题目内容
8.下列热化学方程式正确的是( )| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 已知2SO2(g)+O2(g)?2SO3(g)△H=-196.64kJ•mol-1,在容器中充入1mol SO2和0.5mol O2充分反应,放出的热量为98.32KJ | |
| C. | 已知在120C、101kPa时,1gH2燃烧生成水蒸气放出121KJ,其热化学方程式表示为H2(g)+$\frac{1}{2}$O2(g)=2H2O(l)△H=-242KJ/mol | |
| D. | CO(g) 的燃烧热是283.0kJ•mol-1,则CO2(g)=CO(g)+$\frac{1}{2}$O2(g)△H=+283kJ/mol |
分析 A.燃烧热中生成水为液态;
B.为可逆反应,1mol SO2和0.5mol O2不能完全转化;
C.1gH2燃烧生成水蒸气放出121KJ,则1molH2燃烧生成水蒸气放出121KJ×2=242KJ;
D.CO(g) 的燃烧热是283.0kJ•mol-1,则CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol,互为逆反应时,焓变的数值相同,符号相反.
解答 解:A.甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3 kJ•mol-1,故A错误;
B.为可逆反应,物质的量与热量成正比,且1mol SO2和0.5mol O2不能完全转化,则放出的热量小于98.32KJ,故B错误;
C.1gH2燃烧生成水蒸气放出121KJ,则1molH2燃烧生成水蒸气放出121KJ×2=242KJ,热化学方程式表示为H2(g)+$\frac{1}{2}$O2(g)=2H2O(g)△H=-242KJ/mol,故C错误;
D.CO(g) 的燃烧热是283.0kJ•mol-1,则CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol,则CO2(g)=CO(g)+$\frac{1}{2}$O2(g)△H=+283kJ/mol,故D正确;
故选D.
点评 本题考查热化学方程式,为高频考点,把握燃烧热、物质的量与热量的关系、可逆反应为解答的关键,侧重分析与应用能力的考查,注意热化学方程式中物质的状态,题目难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
17.下列实验操作中,错误的是( )
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球位于蒸馏烧瓶支管处 | |
| C. | 萃取时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 蒸发时,蒸发皿中出现大量固体时即停止加热 |
18.下列自然、生活中的事例不属于氧化还原反应的是( )
| A. | 食物腐败 | B. | 植物光合作用 | C. | 金属生锈 | D. | 石膏点制豆腐 |
15.下列关于氯气的说法不正确的是( )
| A. | 氯气和液氯是两种不同的物质 | |
| B. | 可以用浓硫酸除去氯气中的水蒸气 | |
| C. | 氯气是一种有毒气体,但可用于自来水的杀菌消毒 | |
| D. | 尽管氯气的化学性质很活泼,但是纯净的液氯能用钢瓶贮存 |
3.“农夫山泉”矿泉水瓶的标签上印有如下字样:Ca≥4.0mg/L Mg≥0.5mg/L K≥0.35mg/L Na≥0.8mg/L等,这里的Ca、Mg、K、Na是指( )
| A. | 物质 | B. | 分子 | C. | 原子 | D. | 离子 |
17.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1个甲烷(CH4)分子中有4个C-H键 | |
| B. | 同温、同压下,相同体积的氟气和氢气所含的原子数相等 | |
| C. | 标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA | |
| D. | 在含2molH2SO4的浓H2SO4溶液中加入足量的Zn粉,使其充分反应,则反应结束时转移电子数共4NA(Zn+2H2SO4(浓)→ZnSO4+SO2↑+H2O) |
18.能正确表示下列化学反应的离子方程式是( )
| A. | 氢氧化钡溶液与硫酸的反应 OH-+H+═H2O | |
| B. | 将钠投入到硫酸铜溶液中发生的反应:2Na+Cu2+=2Na++Cu | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | 碳酸钙溶于稀盐酸中 CaCO3+2H+═Ca2++H2O+CO2↑ |
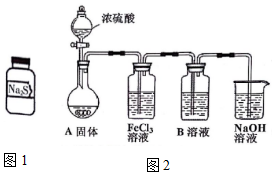 有两瓶标签已被腐蚀的药品,只看到“Na2S”字样(如图1),每瓶药品可能是Na2S、Na2SO3、Na2S2O3、Na2SiO3、Na2SO4中的一种.将两瓶药品分别标记为A、B,
有两瓶标签已被腐蚀的药品,只看到“Na2S”字样(如图1),每瓶药品可能是Na2S、Na2SO3、Na2S2O3、Na2SiO3、Na2SO4中的一种.将两瓶药品分别标记为A、B, .
.