题目内容
18.A、B、C、D四种短周期元素,A、B同主族,C、D同周期.气体A2与气体C2按体积比2:1混合后点燃能够发生爆炸,且产物在常温常压下是一种无色无味的常见液体.B的阳离子与C的简单阴离子的核外电子排布相同.D能形成自然界硬度最大的单质.请根据上述信息回答下列问题.(1)B元素的离子结构示意图为
 ,DA4的结构式为
,DA4的结构式为 ;
;(2)化合物B2C2的电子式为
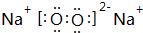 ,D元素在周期表中的位置第二周期IVA族;
,D元素在周期表中的位置第二周期IVA族;(3)A2C2中所含的化学键类型有极性键和非极性键;
(4)写出B2C2和A2C反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑.
分析 A、B、C、D四种短周期元素,D能形成自然界硬度最大的单质,则D为碳元素;C、D同周期,气体A2与气体C2按体积比2:1混合后点燃能够发生爆炸,且产物在常温常压下是一种无色无味的常见液体,该液体应为水,A为H元素、C为O元素;A、B同主族,B的阳离子与C的简单阴离子的核外电子排布相同,则B为Na.
解答 解:A、B、C、D四种短周期元素,D能形成自然界硬度最大的单质,则D为碳元素;C、D同周期,气体A2与气体C2按体积比2:1混合后点燃能够发生爆炸,且产物在常温常压下是一种无色无味的常见液体,该液体应为水,A为H元素、C为O元素;A、B同主族,B的阳离子与C的简单阴离子的核外电子排布相同,则B为Na.
(1)B为Na元素,离子结构示意图为 ,CH4的结构式为
,CH4的结构式为 ,
,
故答案为: ;
; ;
;
(2)化合物Na2O2的电子式为 ,D为碳元素,元素在周期表中的位置:第二周期IVA族,
,D为碳元素,元素在周期表中的位置:第二周期IVA族,
故答案为: ;第二周期IVA族;
;第二周期IVA族;
(3)H2O2中所含的化学键类型有极性键和非极性键,故答案为:极性键、非极性键;
(4)Na2O2和H2O反应的离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语的考查,题目基础性强.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
8.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 2.4g金属镁所含电子数目为0.2NA | B. | 16gCH4所含原子数目为NA | ||
| C. | 17g NH3所含质子数为10 NA | D. | 18g水所含分子数目为18NA |
3.下列实验方案设计中,可行的是( )
| A. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| B. | 用分液的方法分离汽油和煤油 | |
| C. | 用溶解、过滤的方法分离KNO3和NaCl固体混合物 | |
| D. | 将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 |
 ,C的名称乙醛,
,C的名称乙醛,
 .
. .
.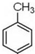 制备高分子化合物
制备高分子化合物 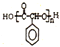 的合成路线流程图(无机试剂任选),合成流程示意图如下:CH3CH2$→_{170℃}^{H_{2}SO_{4}}$CH2$→_{催化剂△}^{H_{2}}$CH3CH3.
的合成路线流程图(无机试剂任选),合成流程示意图如下:CH3CH2$→_{170℃}^{H_{2}SO_{4}}$CH2$→_{催化剂△}^{H_{2}}$CH3CH3.