题目内容
8.设NA为阿伏加德罗常数,下列说法正确的是( )| A. | 2.4g金属镁所含电子数目为0.2NA | B. | 16gCH4所含原子数目为NA | ||
| C. | 17g NH3所含质子数为10 NA | D. | 18g水所含分子数目为18NA |
分析 A、先求出镁的物质的量,然后根据1mol镁含12mol电子来计算;
B、先求出甲烷的物质的量,然后根据1molCH4含5mol原子来分析;
C、先求出氨气的物质的量,然后根据1molNH3含10mol质子来分析;
D、求出水的物质的量,再根据N=n•NA来计算.
解答 解:A、镁的物质的量n=$\frac{m}{M}$=$\frac{2.4g}{24g/mol}$=0.1mol,而1mol镁含12mol电子,故0.1mol电子含1.2mol电子,故A错误;
B、甲烷的物质的量n=$\frac{m}{M}$=$\frac{16g}{16g/mol}$=1mol,而1molCH4含5mol原子,故B错误;
C、氨气的物质的量n=$\frac{m}{M}$=$\frac{17g}{17g/mol}$=1mol,而1molNH3含10mol质子,故C正确;
D、水的物质的量n=$\frac{m}{M}$=$\frac{18g}{18g/mol}$=1mol,分子数N=n•NA=NA,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.按电子排布,可把周期表里的元素划分成5个区,以下元素属于P区的是( )
| A. | Fe | B. | Na | C. | P | D. | La |
3.Na2FeO4是一种高效多功能水处理剂,既能消毒杀菌,又能除去悬浮物杂质.一种制备Na2FeO4的方法为2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列有关说法正确的是( )
| A. | 在反应中氧化剂是Na2O2,还原剂是FeSO4 | |
| B. | 生成2molNa2FeO4时,反应中共有8mol电子转移 | |
| C. | 反应中生成22.4LO2时,共有10mol电子转移 | |
| D. | Na2FeO4净水过程中,既有氧化还原反应发生,又有非氧化还原反应发生 |
3.已知:H-H、N-H、N≡N的键能分别为436KJ/mol,391KJ/mol,946KJ/mol,则:3H2(g)+N2(g)═2NH3(g)△H(KJ/mol)为( )
| A. | +92 | B. | -345.3 | C. | -92 | D. | +345.3 |
13.能使反应2Ag+Cu2+═2Ag++Cu发生的是( )
| A. | 用Cu、Ag分别作原电池两电极,AgNO3溶液作电解质溶液 | |
| B. | 用Ag作电解池的阳极,石墨作电解池的阴极,CuSO4溶液作电解质溶液 | |
| C. | 用Ag、C分别作原电池两电极,CuSO4溶液作电解质溶液 | |
| D. | 用Ag作电解池的阳极,石墨作电解池的阴极,AgNO3溶液作电解质溶液 |
17.设NA为阿伏加德罗常数的值.下列说法正确的是(O-16Fe-56)( )
| A. | 常温下,0.5 mol•L-1 Fe2(SO4)3溶液中含Fe3+数目为1 NA | |
| B. | 标准状况下,22.4L苯中含C-H数目为6NA | |
| C. | 常温常压下,16g O2和O3混合气体中,含氧原子的总数为1NA | |
| D. | 5.6g Fe与足量稀盐酸反应,转移电子数为0.3NA |

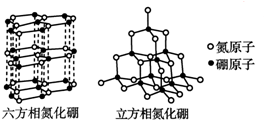 新华网合肥2011年7月21日电,安徽省矿产资源储量评审中心公布:安徽省地质矿产勘查局在本省金寨县沙坪沟探明一处世界级的巨型钼矿,钼金属总储量达到220万吨以上,潜在经济价值超过6 000亿元,钼是制备二维材料的重要金属,英国科学家因制备二维晶体材料--石墨烯获得2010年诺贝尔物理学奖,他们利用“胶带+铅笔”制得单层石墨烯(即从石墨表面剥离下来仅一个原子厚度的材料).之后,人们又制备出一些氮化硼和二硫化钼的二维晶体.根据材料提供的信息,回答相关问题.
新华网合肥2011年7月21日电,安徽省矿产资源储量评审中心公布:安徽省地质矿产勘查局在本省金寨县沙坪沟探明一处世界级的巨型钼矿,钼金属总储量达到220万吨以上,潜在经济价值超过6 000亿元,钼是制备二维材料的重要金属,英国科学家因制备二维晶体材料--石墨烯获得2010年诺贝尔物理学奖,他们利用“胶带+铅笔”制得单层石墨烯(即从石墨表面剥离下来仅一个原子厚度的材料).之后,人们又制备出一些氮化硼和二硫化钼的二维晶体.根据材料提供的信息,回答相关问题. ,DA4的结构式为
,DA4的结构式为 ;
;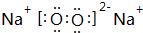 ,D元素在周期表中的位置第二周期IVA族;
,D元素在周期表中的位置第二周期IVA族;