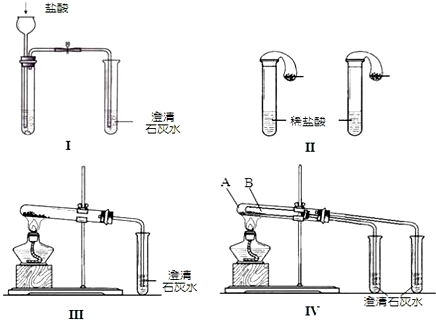
题目内容
10.用98%的浓硫酸(密度为1.84g•cm-3)配制1mol•L-1的稀硫酸180mL,现给出下列仪器(配制过程中可能用到):①50mL量筒;②10mL量筒;③50mL烧杯;④托盘天平;⑤200mL容量瓶;⑥胶头滴管;⑦玻璃棒.配置过程一定需要使用的仪器是( )| A. | ②③⑤⑥⑦ | B. | ③④⑤⑥⑦ | C. | ①②③⑤⑦⑥ | D. | ①③⑤⑥⑦ |
分析 先根据稀释前后溶质的物质的量不变,计算出浓溶液的体积,选取合适的量筒,再根据配制一定物质的量浓度的溶液需要量取、溶解、移液、洗涤、定容、摇匀等操作解答.
解答 解:98%的浓H2SO4的物资的量浓度为c=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$=18.4mol/L,配制1mol•L-1的稀H2SO4 180mL需要用200mL容量瓶,需要浓硫酸的体积为V=$\frac{0.20L×1mol/L}{18.4mol/L}$=0.0108L应选择10.8mL量筒,实验时用50mL量筒量取10.8mL浓硫酸,然后在50mL烧杯中稀释浓硫酸,转移溶液需要玻璃棒,最后定容需要胶头滴管,所以配置过程一定需要使用的仪器为①③⑤⑥⑦;
故选D.
点评 本题主要考查了配制一定物质的量浓度溶液的操作步骤和使用仪器,难度不大,注意量筒的选择.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.新能源的开发利用时人类社会可持续发展的重要课题.下列属于新能源的是( )
| A. | 煤炭 | B. | 氢气 | C. | 天然气 | D. | 石油 |
15.硅及其化合物的应用范围很广,下列说法正确的是( )
| A. | SiO2是酸性氧化物,它不溶于水也不溶于任何酸 | |
| B. | Si+2NaOH+H2O═Na2SiO3+2H2↑,Si为氧化剂 | |
| C. | 硅在地壳中的含量仅次于氧,是应用广泛的半导体材料 | |
| D. | 高温时SiO2与Na2CO3反应放出CO2,所以H2SiO3酸性比H2CO3强 |
20.下表中实验操作、现象和所得出的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 用激光笔照射鸡蛋白水溶液 | 有丁达尔效应 | 鸡蛋白分子直径介于1nm~100nm |
| B | 向某氯化亚铁溶液中加入Na2O2粉末 | 出现红褐色沉淀 | 说明原氯化亚铁已氧化变质 |
| C | 碳酸盐X加热分解,产生的气体通入酸化的BaCl2溶液 | 产生白色沉淀 | X可能是NaHCO3 |
| D | 湿润的KI淀粉试纸靠近气体Y | 试纸变蓝 | Y一定是Cl2 |
| A. | A | B. | B | C. | C | D. | D |
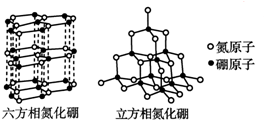 新华网合肥2011年7月21日电,安徽省矿产资源储量评审中心公布:安徽省地质矿产勘查局在本省金寨县沙坪沟探明一处世界级的巨型钼矿,钼金属总储量达到220万吨以上,潜在经济价值超过6 000亿元,钼是制备二维材料的重要金属,英国科学家因制备二维晶体材料--石墨烯获得2010年诺贝尔物理学奖,他们利用“胶带+铅笔”制得单层石墨烯(即从石墨表面剥离下来仅一个原子厚度的材料).之后,人们又制备出一些氮化硼和二硫化钼的二维晶体.根据材料提供的信息,回答相关问题.
新华网合肥2011年7月21日电,安徽省矿产资源储量评审中心公布:安徽省地质矿产勘查局在本省金寨县沙坪沟探明一处世界级的巨型钼矿,钼金属总储量达到220万吨以上,潜在经济价值超过6 000亿元,钼是制备二维材料的重要金属,英国科学家因制备二维晶体材料--石墨烯获得2010年诺贝尔物理学奖,他们利用“胶带+铅笔”制得单层石墨烯(即从石墨表面剥离下来仅一个原子厚度的材料).之后,人们又制备出一些氮化硼和二硫化钼的二维晶体.根据材料提供的信息,回答相关问题. ,DA4的结构式为
,DA4的结构式为 ;
; ,D元素在周期表中的位置第二周期IVA族;
,D元素在周期表中的位置第二周期IVA族;

 ;
;

 .
. ,该物质在NaOH水溶液中加热反应时的化学方程式为
,该物质在NaOH水溶液中加热反应时的化学方程式为 +5NaOH$→_{△}^{H_{2}O}$
+5NaOH$→_{△}^{H_{2}O}$ +HOCH2CH2OH+Na2CO3+NaCl+2H2O.
+HOCH2CH2OH+Na2CO3+NaCl+2H2O.