题目内容
5.如图转化关系中A-H为常见化合物,甲、乙、丙、丁为常见单质,其中甲、丁常温为气体.已知单质乙、化合物A为黄色(或淡黄色)固体.乙经过连续与甲反应后,再与水化合,是工业上制H的反应过程.B、F两种气体都能使澄清石灰水变浑浊.(部分反应物或产物略去)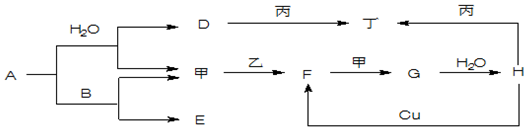
(1)写出下列物质的化学式:ANa2O2 FSO2 甲O2 丙Al
(2)写出下列反应的化学方程式:A与B2Na2O2+2CO2=2Na2CO3+O2;
(3)写出丙与D溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
分析 化合物A是淡黄色固体,能与水反应生成单质甲,可推知A为Na2O2,甲为O2,D为NaOH;B气体能使澄清石灰水变浑浊,其与过氧化钠反应生成氧气,可推知B为CO2、E为Na2CO3,单质乙为淡黄色固体,能与氧气反应生成气体F,且F能使澄清石灰水变浑浊,故乙为S、F为SO2,G为SO3,H为H2SO4;,单质丙能与氢氧化钠、硫酸反应生成单质丁,可推知丙为Al、丁为H2,以此解答该题.
解答 解:(1)由以上分析可知A为Na2O2,F为SO2,甲为O2,丙为Al,故答案为:Na2O2;SO2;O2;Al;
(2)A与B为过氧化钠与二氧化碳的反应,方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(3)丙与D溶液反应是金属铝和氢氧化钠反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题考查无机物的推断,为高频考点,侧重考查学生的分析能力,物质的颜色及转化关系在特殊反应是推断突破口,需要学生熟练掌握元素化合物性质,难度中等.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
10.NA表示阿伏加德罗常数,下列判断正确的是( )
| A. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1 NA | |
| B. | 常温常压下,22.4LCO2中含有的CO2分子数小于NA个 | |
| C. | 等物质的量的N2和CO的质量均为28g | |
| D. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA |
13.正确表示下列反应的离子方程式的是( )
| A. | 将Cl2通入氯化亚铁溶液 Fe2++Cl2=Fe3++2Cl- | |
| B. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2 Fe3++2 Br2+6 Cl | |
| C. | 少量Ca(HCO3)2溶液与过量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 铜与浓硝酸的反应:Cu+4HNO3=Cu 2++NO3-+2NO2↑+2H2O |
10.能源问题是人类生存和社会发展的重要问题,下列关于能源问题的说法正确的是( )
| A. | 我国目前使用的主要能源仍是化石燃料,它属于不可再生能源 | |
| B. | 太阳能、氢能、风能、地热能、生物质能、沼气能等属于新能源 | |
| C. | 解决能源危机的根本途径是尽可能地节约能源,减少浪费 | |
| D. | 风能是太阳能的一种转换形式,所以风能属于二次能源 |
17.向含有下列离子的溶液中加入Na2O2固体后,其离子数量一定没有减少的是( )
| A. | S2- | B. | NH4+ | C. | HCO3- | D. | AlO2- |
14.下列说法正确的是( )
| A. | 手机上用的锂离子电池属于一次电池 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 | |
| D. | 已知反应:2CO(g)=2C(s)+O2(g)的△H>0,△S<0,那么高温下可自发进行 |
15.下列指定反应的离子方程式正确的是( )
| A. | AlCl3溶液中加入过量稀氨水:A13++4NH3•H2O═A1O2-+4NH4++2H2O | |
| B. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 澄清石灰水中滴加少量NaHCO3:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| D. | 溶液中加入过量的NaOH溶液:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O |

 ;反应类型加聚反应;
;反应类型加聚反应;