题目内容
4.氮化铝(AlN)广泛应用于电子、陶瓷等工业领域.在一定条件下,AlN可通过反应:Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO合成.对于该反应,下列叙述正确的是( )| A. | C发生还原反应 | B. | 生成1molAlN转移3mol电子 | ||
| C. | N2是还原剂 | D. | AlN的摩尔质量为41g |
分析 Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO中,N元素的化合价由0降低为-3价,C元素的化合价由0升高为+2价,以此来解答.
解答 解:A.C元素的化合价升高,被氧化,故A错误;
B.每生成1mol AlN,转移1mol×[0-(-3)]=3mol电子,故B正确;
C.N元素的化合价降低,被还原,为氧化剂,故C错误;
D.AlN的摩尔质量为41g/mol,质量的单位为g,故D错误.
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念和转移电子的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.某元素R的阴离子Rn-核外有a个电子,中子数为b,则其质量数为( )
| A. | b+n | B. | b+a+n | C. | b+a-n | D. | b-a+n |
15.钢铁产量可以衡量一个国家重工业的发展水平.已知工业冶炼铁的过程中可能发生反应的热化学方程式如下:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H2
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H3
④C(s)+O2(g)=CO2(g)△H4
⑤C(s)+CO2(g)=2CO(g)△H5
⑥FeO(s)+CO(g)=Fe(s)十CO2(g)△H6
下列推断不正确的是( )
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H2
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H3
④C(s)+O2(g)=CO2(g)△H4
⑤C(s)+CO2(g)=2CO(g)△H5
⑥FeO(s)+CO(g)=Fe(s)十CO2(g)△H6
下列推断不正确的是( )
| A. | △H4<0,△H5>0 | |
| B. | △H6=$\frac{{△H}_{1}×3-{△H}_{2}-{△H}_{3}×2}{6}$ | |
| C. | 2CO(g)+O2(g)=2CO2(g)△H=$\frac{{△H}_{4}-{△H}_{3}}{2}$ | |
| D. | 2Fe3O4(s)+$\frac{1}{2}$O2(g)=3Fe2O3(s)△H=$\frac{{△H}_{4}-{△H}_{5}}{2}$-△H2 |
16.居室装修用石材的放射性常用${\;}_{88}^{226}$Ra作为标准,发现Ra元素的居里夫人(Marie Curie)曾两度获得诺贝尔奖.下列叙述中正确的是( )
| A. | ${\;}_{88}^{226}$Ra原子核外有88个电子 | |
| B. | Ra元素位于元素周期表中第六周期ⅡA族 | |
| C. | RaCl2的熔点比CaCl2高 | |
| D. | Ra(OH)2是一种两性氢氧化物 |

 ;
;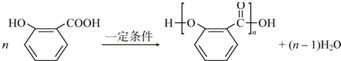 .
.
 ,结构式
,结构式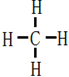 .
.