题目内容
16.居室装修用石材的放射性常用${\;}_{88}^{226}$Ra作为标准,发现Ra元素的居里夫人(Marie Curie)曾两度获得诺贝尔奖.下列叙述中正确的是( )| A. | ${\;}_{88}^{226}$Ra原子核外有88个电子 | |
| B. | Ra元素位于元素周期表中第六周期ⅡA族 | |
| C. | RaCl2的熔点比CaCl2高 | |
| D. | Ra(OH)2是一种两性氢氧化物 |
分析 A、在原子中质子数=电子数;
B、Ra(镭)位于第ⅡA族,与Ca同主族,Ra元素位于元素周期表第七周期ⅡA族;
C、Ra2+的半径大于Ca2+,所以RaCl2的晶格能小于CaCl2;
D、镭单质比Ca金属性强,则氢氧化物为强碱.
解答 解:A、一个Ra的质子数为88,所以原子核外有88个电子,故A正确;
B、Ra(镭)位于第ⅡA族,与Ca同主族,Ra元素位于元素周期表第七周期ⅡA族,故B错误;
C、Ra2+的半径大于Ca2+,所以RaCl2的晶格能小于CaCl2,所以RaCl2的熔点比CaCl2低,故C错误;
D、镭单质比Ca金属性强,氢氧化钙是强碱,则氢氧化物为强碱,故D错误;
故选:A.
点评 本题考查元素的位置及性质,明确Ra与Ca同主族是解答本题的关键,注意性质的相似性和递变性即可解答,题目难度不大.

练习册系列答案
相关题目
2.下列物质的水溶液,既能跟氢氧化钡溶液反应,又能跟稀硫酸反应的是( )
| A. | 烧碱 | B. | 纯碱 | C. | 硝酸铜 | D. | 次氯酸 |
3.下列叙述正确的是( )
| A. | 16gO2所含氧原子个数约为6.02×1023 | |
| B. | 1molN2参加氧化还原反应时电子转移数约为3×6.02×1023 | |
| C. | 物质的量浓度为0.5mol•L-1的MgCl2溶液,含有Cl-数约为6.02×1023 | |
| D. | 常温常压下,22.4LSO2含分子的个数约为6.02×1023 |
4.氮化铝(AlN)广泛应用于电子、陶瓷等工业领域.在一定条件下,AlN可通过反应:Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO合成.对于该反应,下列叙述正确的是( )
| A. | C发生还原反应 | B. | 生成1molAlN转移3mol电子 | ||
| C. | N2是还原剂 | D. | AlN的摩尔质量为41g |
11.下列解释事实的化学方程式或离子方程式不正确的是( )
| A. | 向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2═I2+2H2O | |
| B. | 自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶的PbS,慢慢转变为铜蓝(CuS):Cu2++SO42-+PbS═CuS+PbSO4 | |
| C. | 在燃煤时加入适量石灰石,可减少SO2的排放:2CaCO3+O2+2SO2═2CaSO3+2CO2 | |
| D. | 在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4,可降低土壤的碱性:CaSO4+Na2CO3═CaCO3+Na2SO4 |
1.四种常见元素的性质或结构信息如表,根据信息回答有关问题.
(1)A元素与其同周期相邻两种元素原子的第一电离能由大到小的顺序为N>O>C(用元素符号表示);试解释原因同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素2p能级为半满稳定状态,第一电离能高于同周期相邻元素的.
(2)B元素的低价氧化物分子中心原子的杂化方式为sp2杂化,B元素的最高价氧化物分子的VSEPR构型为平面三角形;B元素与D元素形成分子空间构型为直线形;
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点低(填“高”或“低”),其原因是CO2是分子晶体,SiO2是原子晶体;
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,观察到的现象为先生成蓝色沉淀,后沉淀溶解,最后得到深蓝色溶液;后一现象的离子方程式为:Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++4H2O+2OH-.
(5)C晶体的堆积方式如图所示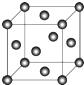 ,设晶胞边长为a cm,阿伏伽德罗常数用NA表示,则晶胞中C原子的配位数为12,C晶体的密度为$\frac{4×64}{{a}^{3}×{N}_{A}}$g•cm-3(要求写表达式,可以不简化).
,设晶胞边长为a cm,阿伏伽德罗常数用NA表示,则晶胞中C原子的配位数为12,C晶体的密度为$\frac{4×64}{{a}^{3}×{N}_{A}}$g•cm-3(要求写表达式,可以不简化).
| 元素 | A | B | C | D |
| 性质 或结 构信息 | 原子核外有两个电子层,最外层有3个未成对电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为:[Ar]3 d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中一种是冶炼金属工业的常用还原剂 |
(2)B元素的低价氧化物分子中心原子的杂化方式为sp2杂化,B元素的最高价氧化物分子的VSEPR构型为平面三角形;B元素与D元素形成分子空间构型为直线形;
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点低(填“高”或“低”),其原因是CO2是分子晶体,SiO2是原子晶体;
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,观察到的现象为先生成蓝色沉淀,后沉淀溶解,最后得到深蓝色溶液;后一现象的离子方程式为:Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++4H2O+2OH-.
(5)C晶体的堆积方式如图所示
 ,设晶胞边长为a cm,阿伏伽德罗常数用NA表示,则晶胞中C原子的配位数为12,C晶体的密度为$\frac{4×64}{{a}^{3}×{N}_{A}}$g•cm-3(要求写表达式,可以不简化).
,设晶胞边长为a cm,阿伏伽德罗常数用NA表示,则晶胞中C原子的配位数为12,C晶体的密度为$\frac{4×64}{{a}^{3}×{N}_{A}}$g•cm-3(要求写表达式,可以不简化).
8.下列离子方程式书写正确的是( )
| A. | 氢氧化铁溶于氢碘酸中$Fe{(OH)_3}+3{H^+}=F{e^{3+}}+3{H_2}O$ | |
| B. | 次氯酸钙溶液中通入过量的二氧化碳Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | |
| C. | 向100mL 0.1moL/L的溴化亚铁溶液中通入0.015 mol的氯气$2F{e^{2+}}+4B{r^-}+3C{l_2}=2F{e^{3+}}+2B{r_2}+6C{l^-}$ | |
| D. | 向明矾溶液逐滴加入氢氧化钡溶液至铝离子刚好完全沉淀$A{l^{3+}}+S{O_4}^{2-}+B{a^{2+}}+3O{H^-}=BaS{O_4}↓+Al{(OH)_3}↓$ |
5.下列变化过程与能量的说法中正确的是( )
| A. | 中和反应是吸热反应 | |
| B. | 燃烧属于放热反应 | |
| C. | 化学键断裂放出能量 | |
| D. | 吸热反应中,反应物总能量大于生成物总能量 |
6.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1.0 L 1.0 mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 23 g Na与足量H2O反应完全后可生成NA个H2分子 | |
| C. | 标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5NA | |
| D. | 常温常压下,46 g的NO2与N2O4混合物含有的原子数为3 NA |