题目内容
下列叙述正确的是( )
| A、1.00 mol NaCl中含有6.02×1023个NaCl分子 |
| B、1.00 mol NaCl中,所有Na+的最外层电子总数为10×6.02×1023 |
| C、欲配置1.00L、1.00 mol.L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 |
| D、1mol Fe与稀硫酸反应Fe失去的电子数为2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、NaCl是离子晶体,不含NaCl分子;
B、Na+的最外层有8个电子;
C、水的体积为1L,当溶质溶于水后,溶液的体积大于1L;
D、Fe与稀硫酸反应后变为+2价.
B、Na+的最外层有8个电子;
C、水的体积为1L,当溶质溶于水后,溶液的体积大于1L;
D、Fe与稀硫酸反应后变为+2价.
解答:
解:A、NaCl是离子晶体,不含NaCl分子,故A错误;
B、1.00molNaCl中含1molNa+,而Na+的最外层有8个电子,故所有Na+的最外层电子总数为8×6.02×1023,故B错误;
C、配置1.00L、1.00 mol.L-1的NaCl溶液,应让溶液的体积为1.00L;而溶剂水的体积为1L,当58.5 g NaCl溶于水后,溶液的体积大于1L,故C错误;
D、Fe与稀硫酸反应后变为+2价,故1mol铁反应后失去2mol电子,故D正确.
故选D.
B、1.00molNaCl中含1molNa+,而Na+的最外层有8个电子,故所有Na+的最外层电子总数为8×6.02×1023,故B错误;
C、配置1.00L、1.00 mol.L-1的NaCl溶液,应让溶液的体积为1.00L;而溶剂水的体积为1L,当58.5 g NaCl溶于水后,溶液的体积大于1L,故C错误;
D、Fe与稀硫酸反应后变为+2价,故1mol铁反应后失去2mol电子,故D正确.
故选D.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、通入足量CO2后的溶液中:Na+、SiO32-、C6H5O-、CH3COO- | ||
B、
| ||
| C、pH=0的溶液:Al3+、Ag(NH3)2+、Cl-、SO42- | ||
| D、c(ClO-)=1.0 mol?L-1的溶液:Na+、SO32-、S2-、SO42- |
FeCl3溶液、Fe(OH)3胶体共同具备的性质是( )
| A、都呈透明的红褐色 |
| B、都比较稳定,密封保存一段时间都不会产生沉淀 |
| C、分散质颗粒直径相同 |
| D、当有光线透过时,都能产生丁达尔效应 |
下列关于化学用语叙述正确的是( )
A、丙烷分子的球棍模型: |
B、甲醛的电子式: |
| C、乙醇的结构简式:C2H6O |
| D、乙烯的结构式:CH2=CH2 |
下列化学用语表达正确的是( )
A、对-硝基甲苯的结构简式: |
B、CH2F2的电子式: |
| C、16O2与18O2互为同素异形体 |
| D、乙炔的最简式:CH |
下列叙述正确的是( )
| A、1molNaOH的质量为40g?mol-1 |
| B、标准状况下,1molH2O2的体积为22.4L |
| C、3.01×1023个SO2分子的质量为32g |
| D、CH4的摩尔质量为16g |
下列化学用语表述一定正确的是( )
A、甲醛的电子式: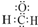 | ||||
B、用铜电极电解盐酸溶液:2H++2Cl
| ||||
C、溴乙烷与氢氧化钠水溶液共热:C2H5Br+OH-
| ||||
| D、澄清石灰水中加入过量的小苏打溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |


 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物,其核磁共振氢谱图中峰面积之比为1:2:2:1,则符合上述条件的所有同分异构体的结构简式是
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物,其核磁共振氢谱图中峰面积之比为1:2:2:1,则符合上述条件的所有同分异构体的结构简式是 和其他无机物合成
和其他无机物合成 的最合理的方案(不超过4步).例如:
的最合理的方案(不超过4步).例如: