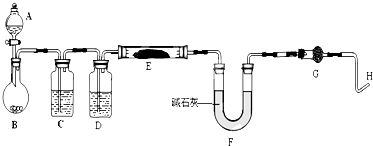
题目内容
根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量Ar(Cu)(近似值)的实验.先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H20),由此计算Ar(Cu).为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4Cl与Ca(OH)2的量足以产生使CuO完全还原的氨气):
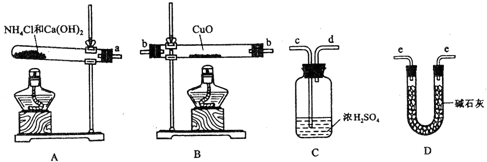
请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为 ;
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→ ;
(3)在本实验中,若测得m(CuO)=a g,m(H2O)=b g,则Ar(Cu)= ;
(4)在本实验中,使测定结果Ar(Cu)偏大的是 (填序号);
①CuO未完全起反应
②CuO不干燥
③CuO中混有不反应的杂质
④碱石灰不干燥
⑤NH4Cl与Ca(OH)2混合物不干燥.

请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→
(3)在本实验中,若测得m(CuO)=a g,m(H2O)=b g,则Ar(Cu)=
(4)在本实验中,使测定结果Ar(Cu)偏大的是
①CuO未完全起反应
②CuO不干燥
③CuO中混有不反应的杂质
④碱石灰不干燥
⑤NH4Cl与Ca(OH)2混合物不干燥.
考点:相对分子质量的测定
专题:实验设计题
分析:(1)氨气具有弱还原性,在加热条件下可以被氧化铜氧化,生成氮气、铜和水;
(2)根据题干可知需测定生成水的质量,生成的氨气需先通过碱石灰干燥、再在与氧化铜反应,最后用碱石灰吸收生成的水,以测得生成水的质量;
(3)由反应方程式可知氧化铜和水的物质的量相等,列出关系式计算即可;
(4)根据Ar(Cu)=
,从是否影响a或b来分析误差.
(2)根据题干可知需测定生成水的质量,生成的氨气需先通过碱石灰干燥、再在与氧化铜反应,最后用碱石灰吸收生成的水,以测得生成水的质量;
(3)由反应方程式可知氧化铜和水的物质的量相等,列出关系式计算即可;
(4)根据Ar(Cu)=
| 18a |
| b |
解答:
解:(1)氨气具有弱还原性,在加热条件下可以被氧化铜氧化,反应物为氮气、铜和水,反应的化学方程式为2NH3+3CuO
3Cu+3H2O+N2,故答案为:2NH3+3CuO
3Cu+3H2O+N2;
(2)因为需要测定反应后生成物水的质量,所以必需保证通入的氨气是纯净干燥的,由于浓硫酸可以与氨气反应,因此只能通过碱石灰进行干燥,再通入氧化铜进行反应,最后在通入碱石灰吸收反应生成的水,以测得生成水的质量,所以正确的顺序为a→e→b→e,故答案为:a→e→b→e;
(3)根据反应方程式
2NH3+3CuO
3Cu+3H2O+N2;
3 3
可知氧化铜和水的物质的量相等,所以有以下关系式:
=
,
解得Ar(Cu)=
=
-16,故答案为:
-16;
(4)由(3)可知得Ar(Cu)=
-16,
①若Cu0未完全起反应,说明b偏小,结果偏大;
②若CuO不干燥,说明a偏小,b偏大,结果偏低;
③若Cu0中混有不反应的杂质,说明b偏小,结果偏大;
④若碱石灰不干燥,说明氨气干燥不彻底,b偏大,结果偏低;
⑤若NH4C1与Ca(OH)2混合物不干燥,但只要氨气干燥彻底,对结果不影响.
所以选项①③正确,故答案为:①③.
| ||
| ||
(2)因为需要测定反应后生成物水的质量,所以必需保证通入的氨气是纯净干燥的,由于浓硫酸可以与氨气反应,因此只能通过碱石灰进行干燥,再通入氧化铜进行反应,最后在通入碱石灰吸收反应生成的水,以测得生成水的质量,所以正确的顺序为a→e→b→e,故答案为:a→e→b→e;
(3)根据反应方程式
2NH3+3CuO
| ||
3 3
可知氧化铜和水的物质的量相等,所以有以下关系式:
| a |
| Ar(Cu)+16 |
| b |
| 18 |
解得Ar(Cu)=
| 18a-16b |
| b |
| 18a |
| b |
| 18a |
| b |
(4)由(3)可知得Ar(Cu)=
| 18a |
| b |
①若Cu0未完全起反应,说明b偏小,结果偏大;
②若CuO不干燥,说明a偏小,b偏大,结果偏低;
③若Cu0中混有不反应的杂质,说明b偏小,结果偏大;
④若碱石灰不干燥,说明氨气干燥不彻底,b偏大,结果偏低;
⑤若NH4C1与Ca(OH)2混合物不干燥,但只要氨气干燥彻底,对结果不影响.
所以选项①③正确,故答案为:①③.
点评:本题主要考查氨气的制备、净化、干燥和利用方程式进行的计算以及有关误差分析,一定要认真、细致的分析问题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列叙述正确的是( )
| A、1.00 mol NaCl中含有6.02×1023个NaCl分子 |
| B、1.00 mol NaCl中,所有Na+的最外层电子总数为10×6.02×1023 |
| C、欲配置1.00L、1.00 mol.L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 |
| D、1mol Fe与稀硫酸反应Fe失去的电子数为2NA |
下列叙述正确的是( )
| A、稀硝酸、稀硫酸均能将木炭氧化成二氧化碳 |
| B、Na2O2与水反应、红热的Fe与水蒸气反应均生成碱 |
| C、Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物 |
| D、CO2、HCl、NH3的水溶液都能导电,它们均属于电解质 |
同温同压下,等质量的CO和CO2气体相比较,下列叙述中正确的是( )
| A、所含碳原子数比为1:1 |
| B、体积比为11:7 |
| C、密度比为7:11 |
| D、分子数比为7:11 |
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
| 物质 编号 | 物质转化关系 | 甲 | 乙 | 丙 | 丁 |
| ① |  | Cu | CuO | CuSO4 | Cu(NO3)2 |
| ② | Na2CO3 | NaOH | NaHCO3 | CO2 | |
| ③ | (NH4)2SO3 | CaSO3 | SO2 | NH4HSO3 | |
| ④ | Fe | FeCl3 | FeCl2 | Fe(NO3)2 |
| A、①②③④ | B、①②③ |
| C、①③④ | D、②④ |
将等质量的铜片在酒精灯上加热后,分别插入下列溶液中,放置片刻,铜片质量减小的是( )
| A、硝酸 | B、无水乙醇 |
| C、石灰水 | D、盐酸 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、在标准状况下,11.2L 氦气含有NA个氦原子 |
| B、25℃,1.01×105Pa,64gSO2中含有的原子数为3NA |
| C、11.2L CO含有的分子数为0.5NA |
| D、1mol氧分子含有的电子数与1mol氮气含有的电子数之比为16:7 |