题目内容
5.查资料得:HNO2是一种弱酸且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+.AgNO2是一种难溶于水、易溶于酸的化合物.试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+.若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是D(填序号单选).
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是B(填序号单选).
A.测定这两种溶液的pH B.利用焰色反应观察火焰颜色来区别
C.在酸性条件下加入KI-淀粉溶液来区别 D. 用AgNO3和HNO3两种试剂来区别
(3)某同学把新制氯水滴入NaNO2溶液中,观察到绿色褪去,
请写出该反应的离子方程式:NO2-+Cl2+H2O=NO3-+2H++2Cl-
(4)Fe与过量稀硫酸反应可以制取FeSO4.若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是C(填序号).
A.Cl2 B.Fe C.H2O2 D.HNO3
(5)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体,起到净水消毒作用,高铁酸钾(K2FeO4)可以通过2FeSO4+6K2O2→2K2FeO4+2K2O+2K2SO4+O2↑制得,在这个反应中,若在标准状况下,收集到2.24L的O2,则被氧化的K2O2是0.1 mol.
分析 (1)由题给信息可知Fe2+转化为Fe3+而中毒,服用维生素C可以解毒,说明在维生素C作用下Fe3+又转化为Fe2+;
(2)A.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性;
B.甲基橙的变色范围是3.1-4.4;
C.酸性条件下,亚硝酸根离子能被碘离子还原生成一氧化氮,同时生成碘单质;
D.亚硝酸根离子不和银离子反应,氯离子和银离子反应生成白色沉淀;
(3)把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,二者发生氧化还原反应,
(4)Cl2、HNO3都能氧化亚铁离子,但能引入新的杂质,铁不能氧化亚铁离子,双氧水的还原产物是水,不引入杂质;
(5)反应中K2O2的O元素化合价部分升高,部分降低,降低的作氧化剂,生成的作还原剂,据此计算.
解答 解:(1)服用维生素C可以解毒,说明在维生素C作用下Fe3+又转化为Fe2+,Fe元素化合价降低,被氧化,则维生素具有还原性,而亚硝酸盐,会导致Fe2+转化为Fe3+,说明亚硝酸盐具有氧化性,在反应中为氧化剂,所以维生素C是还原剂,
故答案为:D;
(2)A.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性,相同物质的量浓度的两种溶液的pH不同,所以可以用测定这两种溶液的pH值鉴别,故A不选;
B.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性,甲基橙的变色范围是3.1-4.4,所以亚硝酸钠和氯化钠溶液加入甲基橙后溶液都呈黄色,反应现象相同,所以不能用甲基橙鉴别,故B选;
C.在酸性条件下,亚硝酸钠和碘离子反应方程式为2NO2-+2I-+4H+=2NO↑+I2+2H2O,碘遇淀粉变蓝色,氯离子和碘离子不反应,所以反应现象不同,所以可以用酸性条件下的KI淀粉试液来区别,故C不选;
D.亚硝酸根离子不和银离子反应,氯离子和银离子反应生成不溶于硝酸的白色沉淀,反应现象不同,所以可以用AgNO3和HNO3两种试剂来区别,故D不选;
故答案为:B;
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,反应的离子方程式为:NO2-+Cl2+H2O=NO3-+2H++2Cl-,
故答案为:NO2-+Cl2+H2O=NO3-+2H++2Cl-;
(4)由于Cl2、HNO3都能氧化亚铁离子,但能引入新的杂质,铁不能氧化亚铁离子,双氧水的还原产物是水,不引入杂质,所以正确是双氧水,
故答案为:C;
(5)反应中K2O2的O元素化合价部分升高,部分降低,降低的作氧化剂,生成的作还原剂,K2O2转化为O2被氧化,氧气为01.mol,则被氧化的K2O2是0.1mol;
故答案为:0.1.
点评 本题考查综合考查氧化还原反应、铁盐和亚铁盐的相互转化、亚硝酸盐的性质,注意二价铁离子和三价铁离子的检验是高考的热点,涉及了化学方程式的配平,为高频考点,侧重于学生的分析能力的考查,注意相关基础知识的积累,难度不大.

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
| A. | 此反应不可能是复分解反应 | |
| B. | 若金属1是锌,则金属2可能是铁 | |
| C. | 还原性:金属1>金属2 | |
| D. | 若金属2是铜,则生成2 mol铜时反应过程中转移2 mol电子 |
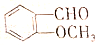 有多种同分异构体.其中含有苯环且能发生水解反应的有( )
有多种同分异构体.其中含有苯环且能发生水解反应的有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
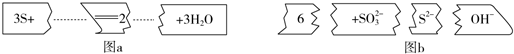
| A. | 配平后的化学计量数依次为3、1、2、6、3 | |
| B. | 若有1 mol S被氧化,则生成2 mol S2- | |
| C. | 氧化剂与还原剂的物质的量之比为1:2 | |
| D. | 2 mol S参加反应有3 mol电子发生转移 |
 I2在KI溶液中存在平衡:I2(aq)+I-(aq)?I3-(aq),某I2、KI混合溶液中,c($I_3^-$)与温度T的平衡曲线图如图.下列说法不正确的是( )
I2在KI溶液中存在平衡:I2(aq)+I-(aq)?I3-(aq),某I2、KI混合溶液中,c($I_3^-$)与温度T的平衡曲线图如图.下列说法不正确的是( )| A. | 反应I2(aq)+I-(aq)?I3-(aq) 的△H>0 | |
| B. | 若温度为T1、T2,反应的平衡常数分别为 K1、K2,则K1>K2 | |
| C. | 若反应进行到状态D时,一定有v正>v逆 | |
| D. | 状态A与状态B相比,状态A的c (I2) 小 |
| A. | 升高温度,B的百分含量增加 | |
| B. | 当容器中气体的密度不变时,反应达到平衡 | |
| C. | 加入少量K,逆反应速率增大 | |
| D. | 平衡后加入A,上述反应的△H增大 |
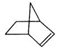 ,降冰片烯在一定的条件下可以转化为降冰片烷(如图所示):
,降冰片烯在一定的条件下可以转化为降冰片烷(如图所示): ,则降冰片烷的二氯取代物共有10种.
,则降冰片烷的二氯取代物共有10种.