题目内容
15.某温度下,体积一定的密闭容器中进行如下可逆反应:A(g)+B(g)?P(g)+K(s)△H>0.下列叙述正确的是( )| A. | 升高温度,B的百分含量增加 | |
| B. | 当容器中气体的密度不变时,反应达到平衡 | |
| C. | 加入少量K,逆反应速率增大 | |
| D. | 平衡后加入A,上述反应的△H增大 |
分析 A、升高温度,平衡正向移动;
B、当容器中气体的密度不变时,说明气体的质量不变;
C、K是固体,加入少量K,逆反应速率不变;
D、反应热△H与物质的化学计量数有关,与参加反应的物质的物质的量无关.
解答 解:A、升高温度,平衡正向移动,B的百分含量减少,故A错误;
B、当容器中气体的密度不变时,说明气体的质量不变,说明正逆反应速率相等,达平衡状态,故B正确;
C、K是固体,加入少量K,K的浓度不变,逆反应速率不变,故C错误;
D、反应热△H与物质的化学计量数有关,物质的化学计量数不变,热化学方程式中反应热不变,与参加反应的物质的物质的量无关,故D错误;
故选B.
点评 本题考查平衡移动、外界条件对平衡的影响、平衡状态判断等,难度不大,注意基础知识的掌握.

练习册系列答案
相关题目
6.下列指定反应的离子方艘式方程式正确的是( )
| A. | 用纯碱溶液溶解苯酚:CO32-+C6H5OH→C6H5O-+HCO3- | |
| B. | 用强碱溶液吸收工业制取硝酸尾气NO+NO2+2OH-=2NO3-+H2O | |
| C. | 用二氧化锰和浓盐酸反应制氯气:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| D. | 向AlCl3溶液中滴加过量的氨水:Al3++4NH3•H2O=AlO2-+2H2O |
10.在恒温恒容的密闭容器中,发生反应:3A(g)+B(g)?xC(g)Ⅰ.将3mol A和2mol B,在一定条件下反应,达到平衡时C的体积分数为a;Ⅱ.若A、B、C起始投入的物质的量分别为n(A)、n(B)、n(C),在相同条件下达到平衡时,C的体积分数也为a.下列有关叙述正确的是( )
| A. | 若Ⅰ达到平衡时,A、B、C各增加1mol,则B的转化率一定增大 | |
| B. | 若向平衡Ⅰ中再加入6mol A,4mol B.测得C的体积分数大于a,可断定x>4 | |
| C. | 若x=2,则体系Ⅱ起始物质的量应满足:3n(B)=n(A)+3 | |
| D. | 若体系Ⅱ起始物质的量满足3n(c)+4n(A)=12n(B),则可推断:x=4 |
20.在CO2中,Mg燃烧生成MgO和C.下列说法正确的是( )
| A. | 在该反应条件下,Mg的还原性强于C的还原性 | |
| B. | Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg) | |
| C. | 元素C的单质只存在金刚石和石墨两种同素异形体 | |
| D. | 该反应中化学能全部转化为热能 |
7.中药狼把草的成分之一M具有消炎杀菌作用,M的结构如图所示.下列叙述正确的是( )
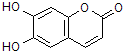

| A. | M的相对分子质量是180 | |
| B. | 1 mol M最多能与2 mol Br2发生反应 | |
| C. | M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 | |
| D. | 1 mol M与足量H2反应,最多消耗5 mol H2 |
4.0.1mol/LNa2S溶液,下列说法正确的是( )
| A. | c(Na+)=2c(S2-) | B. | c(OH-)=c(H+)+c(HS-)+2c(H2S) | ||
| C. | c(Na+)>c(S2-)>c(HS-)>c(OH-) | D. | c(Na+)+c(H+)=c(OH-)+c(HS-)+c(S2-) |
5.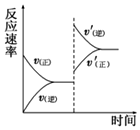 在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,下列有关叙述正确的是( )
在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,下列有关叙述正确的是( )
 在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,下列有关叙述正确的是( )
在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,下列有关叙述正确的是( )| A. | 正反应是吸热反应,m+n>p+q | B. | 逆反应是吸热反应,m+n<p+q | ||
| C. | 正反应是吸热反应,m+n<p+q | D. | 逆反应是吸热反应,m+n>p+q |
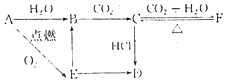 请回答下列问题:
请回答下列问题: