题目内容
13.向由Fe、FeO和Fe2O3组成的混合物中加入100mL2mol/L的盐酸,恰好使混合物完全溶解,并放出448mL的气体(标准状况),在所得的溶液中加入KSCN溶液无血红色出现,则固体混合物的质量为6.88g.分析 Fe、FeO、Fe2O3的混合物中加入盐酸恰好使混合物完全溶解,生成了铁的氯化物,因加入KSCN 溶液,无血红色出现,说明只生成氯化亚铁,根据氯元素守恒可知道氯化亚铁的量,进而求得铁元素的质量,根据HCl的物质的量可结合氢气的物质的量可计算O的质量,混合物中=铁元素质量+氧元素质量;
解答 解:用盐酸溶解后,得到的产物加 KSCN 溶液,无血红色出现,说明得到的产物是氯化亚铁,即混合物中的铁元素全在氯化亚铁中,
盐酸的物质的量为:2mol/L×0.1L=0.2mol,
根据氯元素守恒,则n(Fe)=n(FeCl2)=$\frac{1}{2}$×n(HCl)=0.1mol,m(Fe)=0.1mol×56g/mol=5.6g,
根据H元素守恒,有2HCl$\stackrel{FexOy}{→}$H2O,2HCl$\stackrel{Fe}{→}$H2,
生成氢气的物质的量为:n(H2)=$\frac{0.448L}{22.4L/mol}$=0.02mol,消耗HCl的物质的量为:0.02mol×2=0.04mol,
则与氧化物反应的HCl的物质的量为:0.2mol-0.04mol=0.16mol,
所以氧化物中含有n(O)=$\frac{0.16mol}{2}$=0.08mol,m(O)=0.08mol×16g/mol=1.28g,
则混合物的质量=Fe元素质量+O元素质量=5.6g+1.28g=6.88g,
故答案为:6.88.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
10.正确的下列选项的实验操作中是( )
| A. |  移开加热的蒸发皿 | B. |  给试管加热 | ||
| C. |  滴加液体 | D. |  过滤 |
11.下列反应的离子方程式正确的是( )
| A. | 石灰石与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 石灰乳与Na2CO3溶液混合:Ca(OH)2+CO32-═CaCO3↓+2OH- | |
| C. | 铁与稀硫酸:2Fe+6H+═2Fe3++3 H2↑ | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
8. 车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如表:
车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如表:
(1)写出NO与活性炭反应的化学方程式C+2NO?N2+CO2;
(2)计算上述反应T1℃时的平衡常数K1=4;
(3)上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为80%;
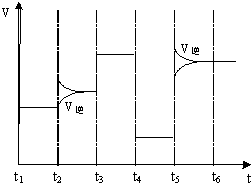
(4)如图为在T1℃达到平衡后在t2、t3、t4、t5时改变某一个反应条件,平衡体系中反应速率随时间变化的情况,且所改变的条件均不同.已知t3-t4阶段为使用催化剂.请判断该反应△H<0(填“>”或“<”).
 车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如表:
车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如表:| 物质 T/℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
(2)计算上述反应T1℃时的平衡常数K1=4;
(3)上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为80%;
(4)如图为在T1℃达到平衡后在t2、t3、t4、t5时改变某一个反应条件,平衡体系中反应速率随时间变化的情况,且所改变的条件均不同.已知t3-t4阶段为使用催化剂.请判断该反应△H<0(填“>”或“<”).
3.下列实验操作中错误的是( )
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 过滤时,应用玻璃棒搅拌漏斗中的待过滤液体 | |
| D. | 称量时,称量物放在称量纸(或称量器皿)上,置于托盘天平的左盘;砝码放在托盘天平的右盘中 |
 ; (2)铝离子的结构示意图:
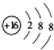
; (2)铝离子的结构示意图: ;
;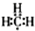
 ; (6)NH4Cl的电子式:
; (6)NH4Cl的电子式: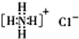 ;
; ,氯化钙
,氯化钙 ,硫化氢 结构式:H-S-H.以上三种物质中其中属于共价化合物的是H2S,晶体类型为分子晶体.
,硫化氢 结构式:H-S-H.以上三种物质中其中属于共价化合物的是H2S,晶体类型为分子晶体. (1)区分晶体和非晶体常用方法为X-射线衍射实验.
(1)区分晶体和非晶体常用方法为X-射线衍射实验.