题目内容
11. 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:从反应开始到10s,X的物质的量减少了0.8 mol,Z的物质的量浓度增大了0.8 mol/L,用Z表示的反应速率为0.08 mol/(L•s).
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:从反应开始到10s,X的物质的量减少了0.8 mol,Z的物质的量浓度增大了0.8 mol/L,用Z表示的反应速率为0.08 mol/(L•s).
分析 X的物质的量减少的量为:1.2-0.4=0.8mol;Z的物质的量浓度增大,c=$\frac{△n}{V}$;根据v=$\frac{\frac{△n}{V}}{△t}$计算出从反应开始到10s时用Z表示的反应速率.
解答 解:X的物质的量减少的量为:1.2-0.4=0.8mol;c=$\frac{△n}{V}$=$\frac{1.6mol}{2L}$=0.8 mol/L;v=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{1.6}{2}}{10}$=0.08 mol/(L•s),故答案为:0.8mol; 0.8 mol/L; 0.08 mol/(L•s).
点评 本题考查了化学平衡的计算,题目难度中等,明确图象曲线变化的含义为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
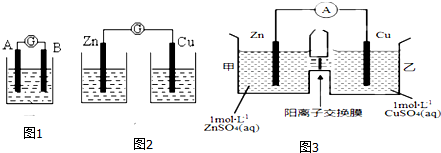
1. 用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示.则下列说法错误的是( )
用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示.则下列说法错误的是( )
 用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示.则下列说法错误的是( )
用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示.则下列说法错误的是( )| A. | 构成原电池时b极反应为Cu2++2e-═Cu | |
| B. | 构成电解池时a极质量一定减少 | |
| C. | 构成电解池时b极质量可能减少也可能增加 | |
| D. | 构成的原电池或电解池工作后可能产生大量气体 |
6.常温下,对于醋酸溶液的下列说法中,正确的是( )
| A. | 0.1 mol•L-1的醋酸溶液中加水稀释,溶液中c(OH-)减小 | |
| B. | 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) | |
| C. | 与同浓度的盐酸比较,分别加水稀释100倍,稀释后溶液中c(H+)醋酸>c(H+)盐酸 | |
| D. | 0.1 mol•L-1的醋酸与等浓度等体积的NaOH溶液反应后的溶液中:c(CH3COO-)+c(CH3COOH)=0.1mol/L |
16.已知:①C(s)+$\frac{1}{2}$O2(g)═CO(g);△H=-110.5kJ•mol-1
②C(s)+O2(g)═CO2(g);△H=-393.51kJ•mol-1
则反应C(s)+CO2(g)═2CO(g)的△H为( )
②C(s)+O2(g)═CO2(g);△H=-393.51kJ•mol-1
则反应C(s)+CO2(g)═2CO(g)的△H为( )
| A. | -283.01 kJ•mol-1 | B. | +172.51 kJ•mol-1 | ||
| C. | +283.01 kJ•mol-1 | D. | -172.51 kJ•mol-1 |
3.下列说法正确的是( )
①非金属元素不可能组成离子化合物
②构成分子晶体的微粒一定含有共价键
③共价化合物中可能含有离子键
④离子化合物中可能含有共价键
⑤非极性键只存在于双原子单质分子里
⑥不同元素组成的多原子分子里的化学键一定都是极性键.
①非金属元素不可能组成离子化合物
②构成分子晶体的微粒一定含有共价键
③共价化合物中可能含有离子键
④离子化合物中可能含有共价键
⑤非极性键只存在于双原子单质分子里
⑥不同元素组成的多原子分子里的化学键一定都是极性键.
| A. | ①②④⑥ | B. | ②④⑤⑥ | C. | ①③⑤⑥ | D. | 只有④ |
20.下列说法正确的是( )
| A. | 非金属元素的原子间不能形成离子化合物 | |
| B. | 所有金属与所有非金属之间都能形成离子键 | |
| C. | 在化合物CaCl2中,两个氯离子之间也存在离子键 | |
| D. | 含有离子键的化合物一定是离子化合物 |
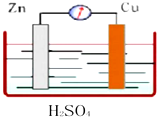 如图所示,Zn、Cu与稀硫酸形成的原电池装置中,负极材料为Zn,负极反应式为Zn-2e-=Zn2+;正极材料为Cu,正极反应式为2H++2e-=H2.
如图所示,Zn、Cu与稀硫酸形成的原电池装置中,负极材料为Zn,负极反应式为Zn-2e-=Zn2+;正极材料为Cu,正极反应式为2H++2e-=H2.