题目内容
6.常温下,对于醋酸溶液的下列说法中,正确的是( )| A. | 0.1 mol•L-1的醋酸溶液中加水稀释,溶液中c(OH-)减小 | |
| B. | 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) | |
| C. | 与同浓度的盐酸比较,分别加水稀释100倍,稀释后溶液中c(H+)醋酸>c(H+)盐酸 | |
| D. | 0.1 mol•L-1的醋酸与等浓度等体积的NaOH溶液反应后的溶液中:c(CH3COO-)+c(CH3COOH)=0.1mol/L |
分析 A.醋酸溶液中存在电离平衡、离子积常数,加水稀释促进醋酸电离,氢离子浓度减小,氢氧根离子浓度增大;
B.醋酸溶液中存在电荷守恒,阴阳离子所带电荷数相同;
C.盐酸完全电离,稀释等体积时,醋酸又电离出氢离子,盐酸溶液中氢离子浓度较大;
D.0.1 mol•L-1的醋酸与等浓度等体积的NaOH溶液反应后的溶液中为醋酸钠溶液,溶液中存在物料守恒.
解答 解:A.0.1 mol•L-1的醋酸溶液中加水稀释,溶液中氢离子浓度减小,依据离子积常数可知溶液中c(OH-)增大,故A错误;
B.醋酸溶液中存在电荷守恒,c(H+)=c(OH-)+c(CH3COO-),故B正确;
C.盐酸完全电离,醋酸存在电离平衡,分别加水稀释100倍,盐酸溶液中氢离子浓度较大,c(H+)醋酸<c(H+)盐酸,故C错误;
D.0.1 mol•L-1的醋酸与等浓度等体积的NaOH溶液反应后的溶液中为醋酸钠溶液,溶液体积增大一倍,溶液中存在物料守恒c(CH3COO-)+c(CH3COOH)=0.05mol/L,故D错误;
故选B.
点评 本题考查了弱电解质的电离平衡、溶液中电荷守恒、物料守恒、溶液中离子浓度大小比较,题目难度中等,解题的关键是理解电离平衡微弱和影响电离平衡的因素的分析应用.

练习册系列答案
相关题目
16.丙烯醇(CH2═CH-CH2OH)可发生的化学反应有( )
①加成②氧化③酯化④加聚⑤取代.
①加成②氧化③酯化④加聚⑤取代.
| A. | 只有①②③ | B. | 只有①②③④ | C. | ①②③④⑤ | D. | 只有①③④ |
17. 如图是酸性介质的氢氧燃料电池构造示意图.关于该电池的说法不正确的是( )
如图是酸性介质的氢氧燃料电池构造示意图.关于该电池的说法不正确的是( )
 如图是酸性介质的氢氧燃料电池构造示意图.关于该电池的说法不正确的是( )
如图是酸性介质的氢氧燃料电池构造示意图.关于该电池的说法不正确的是( )| A. | a极是负极 | B. | 电解质溶液中的H+向b极移动 | ||
| C. | 电子由b通过灯泡流向a | D. | 氢氧燃料电池是环保电池 |
14.如图是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数之和等于B原子的质量数,B原子的原子核内质子数等于中子数.下列叙述正确的是( )
| A | C | |
| B |
| A. | 最高价氧化物对应水化物的酸性:C>B | |
| B. | C单质是氧化性最强的非金属单质 | |
| C. | A的氢化物中不可能含有非极性共价键 | |
| D. | B位于第三周期ⅦA族 |
1.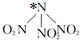 科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3,如图,已知该分子中 N-N-N 键角都是 108.1°,下列有关N(NO2)3的说法不正确的是( )
科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3,如图,已知该分子中 N-N-N 键角都是 108.1°,下列有关N(NO2)3的说法不正确的是( )
 科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3,如图,已知该分子中 N-N-N 键角都是 108.1°,下列有关N(NO2)3的说法不正确的是( )
科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3,如图,已知该分子中 N-N-N 键角都是 108.1°,下列有关N(NO2)3的说法不正确的是( )| A. | 分子中 N、O 间形成的共价键是极性键 | |
| B. | 图中加“*”N原子的杂化方式为sp3 | |
| C. | 该物质既有氧化性又有还原性 | |
| D. | 15.2g 该物质含有 6.02×1022个原子 |
18.表为六种短周期元素的部分性质,下列有关说法错误的是( )
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.66 | 0.70 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
| A. | X与Y可以形成阴离子XY32- | |
| B. | Z的氢化物的沸点比T的氢化物的沸点高 | |
| C. | 元素R的氧化物对应水化物一定为强酸 | |
| D. | 由X形成的化合物QX和XR4,其晶体类型不相同 |
15.现有葡萄糖、丁醛、乙烯的混合物,若其中氧的质量分数为a,则碳的质量分数是( )
| A. | $\frac{6}{7}$(1-a) | B. | $\frac{3}{4}$a | C. | $\frac{1-a}{7}$ | D. | $\frac{12}{13}$(1-a) |
16.下列有关物质的性质与用途对应关系错误的是( )
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | NaHCO3受热易分解,可通过加热方法除去碳酸钠中的碳酸氢钠杂质 | |
| C. | Na2O2能与水或二氧化碳反应产生氧气,可用作宇航员的供氧剂 | |
| D. | Al2O3熔点高,可用作耐高温材料 |
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:从反应开始到10s,X的物质的量减少了0.8 mol,Z的物质的量浓度增大了0.8 mol/L,用Z表示的反应速率为0.08 mol/(L•s).
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:从反应开始到10s,X的物质的量减少了0.8 mol,Z的物质的量浓度增大了0.8 mol/L,用Z表示的反应速率为0.08 mol/(L•s).