题目内容
15.下列说法错误的是( )| A. | 对大型船舶的外壳进行的“牺牲阳极的阴极保护法”,是应用了原电池原理 | |
| B. | 氯化铝的熔点比氧化铝低,因此工业上最好采用电解熔融氯化铝来制备单质铝 | |
| C. | 对于冶炼像钠、钙、镁、铝等这样活泼的金属,电解法几乎是唯一可行的工业方法 | |
| D. | 电镀时,通常把待镀的金属制品作阴极,把镀层金属作阳极 |
分析 A.作原电池正极的金属被保护;
B.氯化铝属于分子晶体,熔融状态不导电;
C.活泼金属采用电解熔融盐或氧化物的方法冶炼;
D.电镀时,镀层作阳极、镀件作阴极.
解答 解:A.对大型船舶的外壳镶嵌锌,锌、铁和海水构成原电池,锌易失电子作负极、铁作正极,作原电池正极的金属被保护,所以对大型船舶的外壳进行的“牺牲阳极的阴极保护法”,是应用了原电池原理,故A正确;
B.氯化铝属于分子晶体,熔融状态为分子,所以熔融态不导电,应该采用电解氧化铝的方法冶炼铝,故B错误;
C.活泼金属采用电解熔融盐或氧化物的方法冶炼,冶炼像钠、钙、镁、铝等这样活泼的金属,电解法几乎是唯一可行的工业方法,故C正确;
D.电镀时,阳极上金属失电子发生氧化反应、阴极上金属阳离子得电子发生还原反应生成金属单质,所以镀层作阳极、镀件作阴极,故D正确;
故选B.
点评 本题考查了原电池及电解池原理及金属的冶炼,根据金属的活泼性强弱确定冶炼方法,知道原电池和电解池各个电极上发生的反应,易错选项是B.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.某有机物A 是农药生产中的一种中间体,其结构简式如下.下列叙述中正确的是( )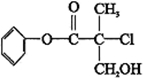

| A. | 有机物A 属于芳香烃 | |
| B. | 有机物A 可以与Br2的CCl4溶液发生加成反应 | |
| C. | 有机物A 与浓硫酸混合加热,可以发生消去反应 | |
| D. | 1 mo1A 与足量的NaOH 溶液反应,最多可以消耗3mol NaOH |
6.下列3个反应:
①S(s)+O2(g)→SO2(g)
②H2(g)+O2(g)→H2O2(l)
③C(s)+H2O(g)→CO(g)+H2(g)
按△S增加的顺序为( )
①S(s)+O2(g)→SO2(g)
②H2(g)+O2(g)→H2O2(l)
③C(s)+H2O(g)→CO(g)+H2(g)
按△S增加的顺序为( )
| A. | ②①③ | B. | ③②① | C. | ②③① | D. | ①③② |
20.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 密闭容器中2molNO与1molO2充分反应后,容器内气体的分子数为2NA | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1molCu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 标准状况下,2.24LCl2溶于足量NaOH中转移电子的数目为0.1NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA |
7.在喷泉实验的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹子,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶,则a和b分别是( )
| a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | 4mol/L NaOH溶液 |
| C | Cl2 | 饱和NaCl溶液 |
| D | NO | 水 |
| A. | A | B. | B | C. | C | D. | D |
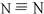 ,氮的氢化物除了氨气,还有一种在常温下呈液态的肼,分子式为N2H4,请写出肼的电子式
,氮的氢化物除了氨气,还有一种在常温下呈液态的肼,分子式为N2H4,请写出肼的电子式 ;
;