题目内容
10.鉴别己烯中是否有少量甲苯,实验方法是先加足量溴水,然后再加入酸性高锰酸钾溶液.分析 己烯含有碳碳双键,可发生加成、氧化反应,甲苯与溴水等不反应,可与酸性高锰酸钾发生氧化还原反应,以此解答该题.
解答 解:因己烯含有碳碳双键,可与溴水发生加成反应,与高锰酸钾发生氧化还原反应,而甲苯与溴水不反应,可与酸性高锰酸钾发生氧化还原反应,则鉴别己烯中是否有少量甲苯,可先加足量溴水,除去己烯,然后再加入酸性高锰酸钾溶液,如褪色,可说明含有甲苯.
故答案为:先加足量溴水,然后再加入酸性高锰酸钾溶液.
点评 本题考查有机物的检验和鉴别,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的差异,把握实验的严密性和合理性的评价,难度不大.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目
6.称取(NH4)2SO4和NH4HSO4混合物样品7.24g,加入含0.1molNaOH的溶液,完全反应,生成NH3 1792ml(标准状况),则(NH4)2SO4和NH4HSO4的物质的量比为( )
| A. | 1:1 | B. | 1:2 | C. | 1.87:1 | D. | 3.65:1 |
1.设NA为阿伏伽德罗常数的值.下列说正确的是( )
| A. | 高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| B. | 室温下,1LpH=12的NaOH溶液中,由水电离的OH-离子数目为0.01NA | |
| C. | 氢氧燃料电池负极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 0.1mol丙烯酸中含有双键的数目为0.1NA |
15.下列说法错误的是( )
| A. | 对大型船舶的外壳进行的“牺牲阳极的阴极保护法”,是应用了原电池原理 | |
| B. | 氯化铝的熔点比氧化铝低,因此工业上最好采用电解熔融氯化铝来制备单质铝 | |
| C. | 对于冶炼像钠、钙、镁、铝等这样活泼的金属,电解法几乎是唯一可行的工业方法 | |
| D. | 电镀时,通常把待镀的金属制品作阴极,把镀层金属作阳极 |
19.涂改液是一种使用率较高的文具,很多同学都喜欢使用涂改液.经实验证实涂改液中含有许多挥发性有害物质,吸入后易引起慢性中毒而头晕、头痛,严重者抽搐、呼吸困难,二氯甲烷就是其中的一种.下列有关说法中不正确的是( )
| A. | 涂改液危害人体健康、污染环境,中小学生最好不要使用或慎用涂改液 | |
| B. | 二氯甲烷沸点较低 | |
| C. | 二氯甲烷易溶于水,涂改液沾到手上时,用水很容易洗去 | |
| D. | 二氯甲烷为四面体的结构,不存在同分异构体 |
20. 已知草酸为二元弱酸:H2C2O4═HC2O4-+H+Ka 1; HC2O4-═C2O42-+H +Ka 2常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42- 三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是( )
已知草酸为二元弱酸:H2C2O4═HC2O4-+H+Ka 1; HC2O4-═C2O42-+H +Ka 2常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42- 三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是( )
 已知草酸为二元弱酸:H2C2O4═HC2O4-+H+Ka 1; HC2O4-═C2O42-+H +Ka 2常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42- 三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是( )
已知草酸为二元弱酸:H2C2O4═HC2O4-+H+Ka 1; HC2O4-═C2O42-+H +Ka 2常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42- 三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是( )| A. | 常温下,Ka 1:Ka 2=1000 | |
| B. | 将相同物质的量 KHC2O4 和 K2C2O4固体完全溶于水可配得 pH 为 4.2 的混合液 | |
| C. | pH=1.2 溶液中:c(K +)+c(H + )=c(OH-)+c(H2C2O4) | |
| D. | 向 pH=1.2 的溶液中加 KOH 溶液将pH增大至4.2的过程中水的电离度一直增大 |
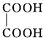
 +NaBr+H2O;
+NaBr+H2O;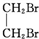 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$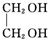 +2NaBr;
+2NaBr;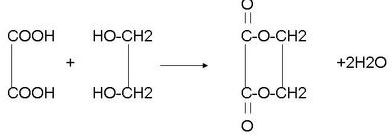 .
.