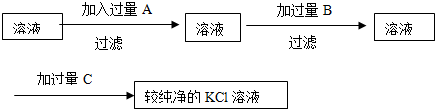
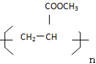
题目内容
8.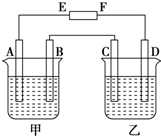 在图中,E和F分别为电源两极;甲烧杯中盛有100mL 0.2mol•L-1 AgNO3溶液,乙烧杯中盛有100mL 0.15mol•L-1 CuCl2溶液,A、B、C、D均为石墨电极,如果电解一段时间后,发现B极增重1.08g,则
在图中,E和F分别为电源两极;甲烧杯中盛有100mL 0.2mol•L-1 AgNO3溶液,乙烧杯中盛有100mL 0.15mol•L-1 CuCl2溶液,A、B、C、D均为石墨电极,如果电解一段时间后,发现B极增重1.08g,则(1)E为正极.
(2)A极的电极反应式为4OH--4e-═2H2O+O2↑,析出气体56mL.(标准状况)
(3)若乙烧杯溶液体积不变,则此时溶液的物质的量浓度将变为mol•L-1.
(4)甲烧杯中滴入石蕊试液,A极附近变红(填A或B);如果继续电解,在甲烧杯中最终得到HNO3溶液(填溶质的化学式).
分析 (1)A、B、C、D均为石墨电极,如果电解一段时间后,发现B极增重1.08g,说明B极生成Ag,应为电解池的阴极,则F为负极,E为正极,C为阳极,D为阴极;
(2)A极与正极相连为阳极,则A极上氢氧根离子失电子;根据电极方程式结合电子守恒计算生成的氧气;
(3)根据电子守恒计算乙中消耗的氯化铜,再求出剩余的氯化铜的浓度;
(4)甲中A极上氢氧根离子失电子,同时生成氢离子,根据电极方程式判断.
解答 解:(1)A、B、C、D均为石墨电极,如果电解一段时间后,发现B极增重1.08g,说明B极生成Ag,应为电解池的阴极,则F为负极,E为正极,C为阳极,D为阴极;
故答案为:正;
(2)A极与正极相连为阳极,则A极上氢氧根离子失电子,A极的电极方程式为:4OH--4e-═2H2O+O2↑;甲中B极的反应为:Ag++e-=Ag,发现B极增重1.08g,则Ag的物质的量为0.01mol,转移电子的物质的量为0.01mol;由4OH--4e-═2H2O+O2↑可知转移电子为0.01mol时生成的氧气为0.0025mol,所以氧气的体积为56ml;
故答案为:4OH--4e-═2H2O+O2↑;56;
(3)D极的反应为Cu2++2e-=Cu,转移电子为0.01mol时,消耗为Cu2+为0.005mol,则剩余的Cu2+为0.10L×0.15mol•L-1-0.005mol=0.01mol,则此时溶液的物质的量浓度将变为$\frac{0.01mol}{0.1L}$=0.1mol•L-1;
故答案为:0.1;
(4)甲中A极上氢氧根离子失电子,同时生成氢离子,所以A极附近变红;甲烧杯中盛有100mL 0.2mol•L-1 AgNO3溶液,其电解方程式为:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$2Ag+O2↑+4HNO3,所以在甲烧杯中最终得到HNO3溶液;
故答案为:A;HNO3.
点评 本题考查了原电池和电解池原理,根据各个电极上发生的反应再结合转移电子相等来分析解答,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 形成离子键的阴阳离子间只存在静电吸引力 | |
| B. | HF、HCl、HBr、HI的热稳定性依次增强 | |
| C. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 | |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |
2FeCl3+2KI═2FeCl2+2KCl+I2 ①
2FeCl2+Cl2═2FeCl3 ②
Co2O3+6HCl(浓)═2CoCl2+Cl2+3H2O ③
判断下列物质的氧化能力由强到弱的顺序是( )
| A. | Cl2>I2>Co2O3>Fe3+ | B. | Cl2>Co2O3>I2>Fe3+ | ||
| C. | Co2O3>Cl2>Fe3+>I2 | D. | I2>Fe3+>Cl2>Co2O3 |
| A. | CH3-O-CH3 | B. | (CH3)3C-CH2-O-CH3 | ||
| C. | (CH3)3C-CH2-O-CH2-C(CH3)3 | D. | (CH3)2C=CH(CH3) |
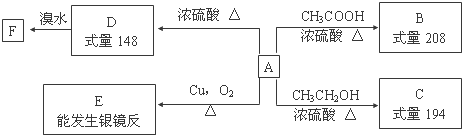
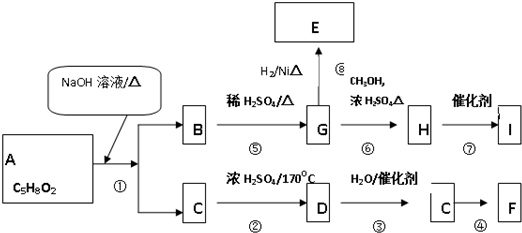
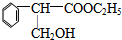 ,F的结构简式为
,F的结构简式为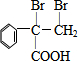 .
.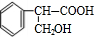 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$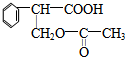 +H2O;②A→E:2
+H2O;②A→E:2 +2H2O.
+2H2O.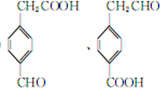 .
. 单质A、B、C与化合物甲、乙之间有如图所示的转化关系(部分产物已省略).
单质A、B、C与化合物甲、乙之间有如图所示的转化关系(部分产物已省略).