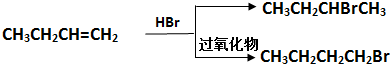
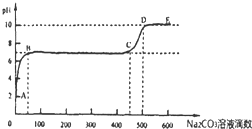
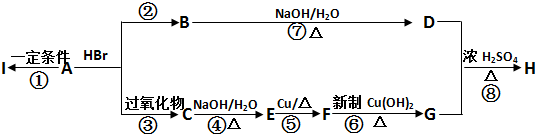题目内容
设NA为阿伏加德罗常数,在标准状况下,下列说法正确的是( )
| A、60g水晶晶体中,含有“Si-O”键的数目为2NA |
| B、14g氮气含有π键数为2NA |
| C、18g冰中含有的氢键数目为2NA |
| D、12g金刚石中含有C-C键的数目为4NA |
考点:阿伏加德罗常数
专题:
分析:A、依据n=
计算物质的量,结合二氧化硅含有四个Si-O键;
B、依据n=
计算物质的量,结合氮气分子结构分析;
C、依据n=
计算物质的量,氢键是分子间作用力;
D、依据n=
计算物质的量,每个碳原子形成四个共价键,镁两个碳原子形成一个共价键.
| m |
| M |
B、依据n=
| m |
| M |
C、依据n=
| m |
| M |
D、依据n=
| m |
| M |
解答:
解:A、依据n=
计算物质的量=
=1mol,结合二氧化硅含有四个Si-O键,60g水晶晶体中,含有“Si-O”键的数目为4NA,故A错误;
B、依据n=
计算物质的量
=0.5mol,结合氮气分子结构分析每个氮气分子含有两个π键;,所以14g氮气含有π键数为NA,故B错误;
C、依据n=
计算物质的量=
=1mol,氢键是分子间作用力,每个水分子形成两个氢键,18g冰中含有的氢键数目为2NA,故C正确;
D、依据n=
计算物质的量=
=1mol,每个碳原子形成四个共价键,每两个碳原子形成一个共价键,12g金刚石中含有C-C键的数目为2NA,故D错误;
故选C.
| m |
| M |
| 60g |
| 60g/mol |
B、依据n=
| m |
| M |
| 14g |
| 28g/mol |
C、依据n=
| m |
| M |
| 18g |
| 18g/mol |
D、依据n=
| m |
| M |
| 12g |
| 12g/mol |
故选C.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是物质结构的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目
将amol小苏打和bmol过氧化钠置于某体积可变的密闭容器中充分加热,反应后测得容器内的氧气为1mol,下列说法一定正确的是( )
| A、b=2 |
| B、容器中一定没有残余的CO2和水蒸气 |
| C、a≥b |
| D、反应中转移的电子数一定为2NA |
设NA为阿佛加德罗常数的数值,下列说法不正确的是( )
| A、常温常压下,1.7g NH3含有NA个电子 |
| B、标准状况下,22.4L水中含H2O分子NA个 |
| C、1molNa完全反应生成NaCl时,失去NA个电子 |
| D、常温常压下,22.4LCO2中含有的CO2分子数小于NA个 |
下列各组离子能大量共存,且溶液为无色透明的是( )
| A、H+、AlO2-、NO3-、Cl- |
| B、MnO4-、H+、K+、NO3- |
| C、Ba2+、Na+、HCO3-、OH- |
| D、K+、SO42-、S2-、Na+ |