题目内容
已知A是气态烃,完全燃烧时产生的CO2和H2O的物质的量之比为1:1,气体A相对于H2的密度为21,在如图变化中,中间产物F跟葡萄糖一样也能跟新制的Cu(OH)2发生反应产生红色沉淀,H有香味,I为高分子化合物.
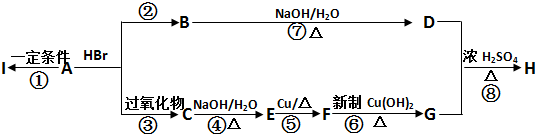
已知: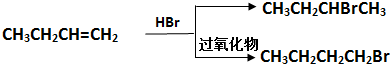
CH3CH2CH2CH2Br
CH3CH2CH2CH2OH
(1)写出下列各步变化的化学方程式(注明反应条件)
反应② ;
反应⑤ ;
反应⑧ .
(2)写出下列反应类型:
反应① ,反应② ,
反应⑤ ,反应⑧ .
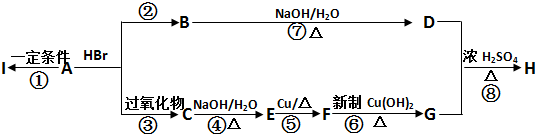
已知:

CH3CH2CH2CH2Br
| NaOH/H2O |
| △ |
(1)写出下列各步变化的化学方程式(注明反应条件)
反应②
反应⑤
反应⑧
(2)写出下列反应类型:
反应①
反应⑤
考点:有机物的推断
专题:有机物的化学性质及推断
分析:气体A相对于H2的密度为21,则Mr(A)=21×2=42,完全燃烧时产生的CO2和H2O的物质的量之比为1:1,所以A中C、H原子个数比为1:2,分子式表示为CnH2n,则12n+2n=42,故n=3,则A分子式为C3H6,A能与HBr发生加成反应,故A为CH2=CHCH3,A与HBr在过氧化物条件下发生加成反应生成C为CH3CH2CH2Br,C发生水解反应生成E为CH3CH2CH2OH,E发生氧化反应生成F为CH3CH2CHO,F进一步发生氧化反应生成G为CH3CH2COOH.A与HBr发生加成反应生成B为CH3CH(Br)CH3,B发生水解反应生成D为CH3CH(OH)CH3,D与G发生酯化反应生成H为CH3CH2COOCH(CH3)2,A发生加聚反应生成高聚物I为 ,据此解答.
,据此解答.
 ,据此解答.
,据此解答.解答:
解:气体A相对于H2的密度为21,则Mr(A)=21×2=42,完全燃烧时产生的CO2和H2O的物质的量之比为1:1,所以A中C、H原子个数比为1:2,分子式表示为CnH2n,则12n+2n=42,故n=3,则A分子式为C3H6,A能与HBr发生加成反应,故A为CH2=CHCH3,A与HBr在过氧化物条件下发生加成反应生成C为CH3CH2CH2Br,C发生水解反应生成E为CH3CH2CH2OH,E发生氧化反应生成F为CH3CH2CHO,F进一步发生氧化反应生成G为CH3CH2COOH.A与HBr发生加成反应生成B为CH3CH(Br)CH3,B发生水解反应生成D为CH3CH(OH)CH3,D与G发生酯化反应生成H为CH3CH2COOCH(CH3)2,A发生加聚反应生成高聚物I为 ,
,
(1)反应②是丙烯与HBr发生加成反应生成CH3CH(Br)CH3,反应化学方程式为:CH3CH2=CH2+HBr→CH3CH(Br)CH3,
反应⑤是CH3CH2CH2OH发生氧化反应生成CH3CH2CHO,反应化学方程式为:2CH3CH2CH2OH+O2
2CH3CH2CH2CHO+2H2O,
反应⑧是醇与羧酸发生酯化反应,反应方程式为:CH3CH2COOH+CH3CH2(OH)CH3
CH3CH2COOCH(CH3)2+H2O,
故答案为:CH3CH2=CH2+HBr→CH3CH(Br)CH3;2CH3CH2CH2OH+O2
2CH3CH2CH2CHO+2H2O CH3CH2COOH+CH3CH2(OH)CH3
CH3CH2COOCH(CH3)2+H2O.
(2)反应①属于加聚反应,反应②属于加成反应,反应⑤属于氧化反应,反应⑧属于取代反应,故答案为:加聚反应;加成反应;氧化反应;取代反应.
 ,
,(1)反应②是丙烯与HBr发生加成反应生成CH3CH(Br)CH3,反应化学方程式为:CH3CH2=CH2+HBr→CH3CH(Br)CH3,
反应⑤是CH3CH2CH2OH发生氧化反应生成CH3CH2CHO,反应化学方程式为:2CH3CH2CH2OH+O2
| Cu或Ag |
| △ |
反应⑧是醇与羧酸发生酯化反应,反应方程式为:CH3CH2COOH+CH3CH2(OH)CH3
| 浓硫酸 |
| △ |
故答案为:CH3CH2=CH2+HBr→CH3CH(Br)CH3;2CH3CH2CH2OH+O2
| Cu或Ag |
| △ |
| 浓硫酸 |
| △ |
(2)反应①属于加聚反应,反应②属于加成反应,反应⑤属于氧化反应,反应⑧属于取代反应,故答案为:加聚反应;加成反应;氧化反应;取代反应.
点评:本题考查有机物推断,结合A发生的反应计算确定A的结构简式,再结合反应条件推断,水解烯烃、卤代烃、醇、羧酸性质与转化,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
关于次氯酸性质的描述,错误的是( )
| A、不稳定,易分解放出氧气 |
| B、能使潮湿的有色布条褪色 |
| C、具有漂白性 |
| D、是一种比碳酸酸性强的酸 |
设NA为阿伏加德罗常数,在标准状况下,下列说法正确的是( )
| A、60g水晶晶体中,含有“Si-O”键的数目为2NA |
| B、14g氮气含有π键数为2NA |
| C、18g冰中含有的氢键数目为2NA |
| D、12g金刚石中含有C-C键的数目为4NA |
 在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol?L-1的NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量关系如图所示.下列叙述错误的是( )
在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol?L-1的NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量关系如图所示.下列叙述错误的是( )| A、x与y的差值为0.01mol |
| B、原溶液中c(Cl-)=0.85mol?L-1 |
| C、原溶液的c(H+)=0.1mol?L-1 |
| D、原溶液中n(Mg2+):n(Al3+)=5:1 |
下列实验中,所选装置或实验设计合理的是( )


| A、用图①和②所示装置进行粗盐提纯 |
| B、用乙醇提取溴水中的溴选择图③所示装置 |
| C、用图④所示装置进行稀盐酸浓缩得到浓盐酸 |
| D、图⑤所示装置中盛有饱和Na2SO3溶液除去SO2中含有的少量HCl |
用蒸馏水湿润过的pH试纸测得某氨基酸溶液的pH等于8,则该氨基酸溶液的pH可能是( )
| A、9 | B、8 | C、7 | D、6 |
下列离子方程式中错误的是( )
| A、明矾净水的原理:Al3++3H2O=Al(OH)3↓+3H+ |
| B、硫酸铝溶液与硫化钠溶液混合:2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑ |
| C、碳酸钠溶液呈碱性的原因:CO32-+2H2O?H2CO3+2OH- |
| D、FeCl3溶液加入碳酸氢钠溶液中:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑ |
下列规律与化学反应的能量变化关系最大的是( )
| A、阿伏加德罗定律 |
| B、盖斯定律 |
| C、勒夏特列原理 |
| D、欧姆定律 |