题目内容
将amol小苏打和bmol过氧化钠置于某体积可变的密闭容器中充分加热,反应后测得容器内的氧气为1mol,下列说法一定正确的是( )
| A、b=2 |
| B、容器中一定没有残余的CO2和水蒸气 |
| C、a≥b |
| D、反应中转移的电子数一定为2NA |
考点:有关混合物反应的计算
专题:
分析:混合物在密闭容器中加热到时,可能发生如下反应:
①2NaHCO3
Na2CO3+H2O+CO2↑,
②2Na2O2+2CO2═2Na2CO3+O2,
③2Na2O2+2H2O═4NaOH+O2,
④2NaOH+CO2═Na2CO3+H2O,
A.由2Na2O2~O2计算参加反应的过氧化钠,过氧化钠可能有剩余;
B.过氧化钠反应完毕后,碳酸氢钠可能继续分解;
C.由2Na2O2~O2,可以计算参加反应的过氧化钠的质量,根据方程式2NaHCO3+2Na2O2
2Na2CO3+2NaOH+O2,计算需要碳酸氢钠的物质的量,但过氧化钠可能剩余,可能完全反应,不能确定碳酸氢钠的物质的量;
D.反应中过氧化钠起氧化剂、还原剂作用,各占一半,结合氧元素化合价计算转移电子数目.
①2NaHCO3
| ||
②2Na2O2+2CO2═2Na2CO3+O2,
③2Na2O2+2H2O═4NaOH+O2,
④2NaOH+CO2═Na2CO3+H2O,
A.由2Na2O2~O2计算参加反应的过氧化钠,过氧化钠可能有剩余;
B.过氧化钠反应完毕后,碳酸氢钠可能继续分解;
C.由2Na2O2~O2,可以计算参加反应的过氧化钠的质量,根据方程式2NaHCO3+2Na2O2
| ||
D.反应中过氧化钠起氧化剂、还原剂作用,各占一半,结合氧元素化合价计算转移电子数目.
解答:
解:混合物在密闭容器中加热时,可能发生如下反应:
①2NaHCO3
Na2CO3+H2O+CO2↑,
②2Na2O2+2CO2═2Na2CO3+O2,
③2Na2O2+2H2O═4NaOH+O2,
④2NaOH+CO2═Na2CO3+H2O,
A.由2Na2O2~O2,可知参加反应的过氧化钠为2mol,但过氧化钠可能有剩余,故A错误;
B.过氧化钠反应完毕后,碳酸氢钠继续分解,可能剩余二氧化碳、水蒸气,故B错误;
C.由2Na2O2~O2,可知参加反应的过氧化钠为2mol,根据方程式可知2NaHCO3+2Na2O2
2Na2CO3+2NaOH+O2,2mol过氧化钠反应需要碳酸氢钠至少为2mol,而过氧化钠可能剩余,可能完全反应,且不能确定碳酸氢钠的物质的量,故C错误;
D.反应中过氧化钠起氧化剂、还原剂作用,各占一半,反应中氧元素化合价由-1价降低为-2价,故生成1mol氧气转移电子为1mol×2×[0-(-1)]=2mol,故转移电子数目为2NA,故D正确.
故选D.
①2NaHCO3
| ||
②2Na2O2+2CO2═2Na2CO3+O2,
③2Na2O2+2H2O═4NaOH+O2,
④2NaOH+CO2═Na2CO3+H2O,
A.由2Na2O2~O2,可知参加反应的过氧化钠为2mol,但过氧化钠可能有剩余,故A错误;
B.过氧化钠反应完毕后,碳酸氢钠继续分解,可能剩余二氧化碳、水蒸气,故B错误;
C.由2Na2O2~O2,可知参加反应的过氧化钠为2mol,根据方程式可知2NaHCO3+2Na2O2
| ||
D.反应中过氧化钠起氧化剂、还原剂作用,各占一半,反应中氧元素化合价由-1价降低为-2价,故生成1mol氧气转移电子为1mol×2×[0-(-1)]=2mol,故转移电子数目为2NA,故D正确.
故选D.
点评:本题考查混合物的有关计算,难度中等,明确可能发生的反应进行讨论,注意过氧化钠可能完全反应,也可能有剩余,由于二氧化碳与氢氧化钠反应,故可以认为过氧化钠先与二氧化碳反应,反应完毕过氧化钠有剩余再与水反应.

练习册系列答案
相关题目
分子式为C3H6Cl2的有机物,发生一元氯代反应后,可以生成两种同分异构体,则原C3H6Cl2的名称是( )
| A、1,2-二氯丙烷 |
| B、1,1-二氯丙烷 |
| C、1,3-二氯丙烷 |
| D、2,2-二氯丙烷 |
2SO2(g)+O2(g)
2SO3(g)是制备硫酸的重要反应.下列叙述正确的是( )
| v2o5 |
| △ |
| A、催化剂V2O5不改变该反应的逆反应速率 | ||
| B、增大反应体系的压强,反应速率一定增大 | ||
| C、该反应是放热反应,降低温度将缩短反应达到平衡的时间 | ||
D、在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO3(g)生成的平均速率v=
|
下列物质不能用于鉴别乙醇和乙醛的是( )
| A、新制氢氧化铜悬浊液 |
| B、氢氧化钠溶液 |
| C、金属钠 |
| D、银氨溶液 |
关于次氯酸性质的描述,错误的是( )
| A、不稳定,易分解放出氧气 |
| B、能使潮湿的有色布条褪色 |
| C、具有漂白性 |
| D、是一种比碳酸酸性强的酸 |
下列说法正确的是( )
| A、形成原电池后,原电池中的阳离子向正极移动 |
| B、原电池中电子流出的一极是正极,发生氧化反应 |
| C、原电池的两极发生的反应均为氧化还原反应 |
| D、原电池是把电能转化为化学能的装置 |
设NA为阿伏加德罗常数,在标准状况下,下列说法正确的是( )
| A、60g水晶晶体中,含有“Si-O”键的数目为2NA |
| B、14g氮气含有π键数为2NA |
| C、18g冰中含有的氢键数目为2NA |
| D、12g金刚石中含有C-C键的数目为4NA |

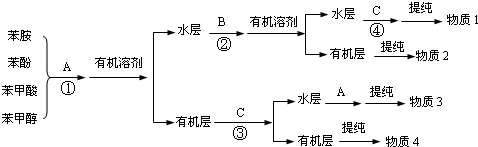
 )有弱碱性,可与盐酸等反应生成盐;
)有弱碱性,可与盐酸等反应生成盐;