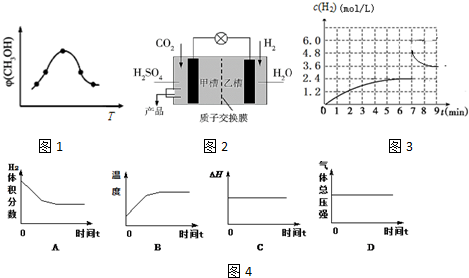
题目内容
14.丙烯是一种重要的化工原料.2000年以来,我国丙烯的使用量已超过乙烯,且一直保持增长趋势.(1)丙烯在酸性催化剂存在下,聚合生成二聚体、三聚体的混合物,将其加入汽油中,可提高汽油的辛烷值.在催化剂存在下,丙烯聚合生成聚丙烯树脂,其反应的化学方程式为
 .
.(2)制取丙烯腈的方法常有如下两种:
方法①:CH═CH+H-CN$\stackrel{催化剂}{→}$CH2═CH-CN
方法②:2CH2═CH-CH2+2NH3+3O2$\stackrel{催化剂}{→}$CH2-CN+6H2O
相比较而言,方法②的优点是生产成本低(原料易得、节能),无毒性.
(3)现以丙烯为原料,合成环酯J.
已知:①烯烃复分解反应是指在催化剂作用下,实现
 两边基团换位的反应.如两个丙烯分子进行烯烃换位,生成丁烯和乙烯.
两边基团换位的反应.如两个丙烯分子进行烯烃换位,生成丁烯和乙烯.2CH2=CHCH3$\stackrel{催化剂}{→}$CH3CH=CHCH3+CH2=CH2
②羧酸和醇在一定条件下可以生成酯:R-OH+R′-COOH→
 +H2O
+H2O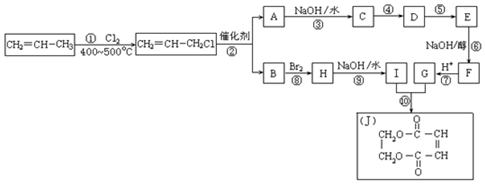
请按要求填空:
(i)写出下列反应的反应类型:①取代反应,⑥消去反应.
(ii)反应④是与HCl加成,设计这一步反应的目的是保护分子中碳碳双键不被氧化,物质E的结构简式是
 .
.(iii)有机化合物C有多种同分异构体,请写出其中属于酯类且属于甲酸酯的所有同分异构体的结构简式HCOOCH2CH2CH3,HCOOCH(CH3)2.
分析 (1)丙烯中含有碳碳双键,在一定条件下能发生加聚反应生成聚丙烯;
(2)对比两种方法可知:方法②比方法①原料丰富,能耗低,且方法①使用了有毒气体HCN而②没有,减少了污染,据此进行判断;
(3)丙烯与氯气在加热条件下发生取代反应生成CH2=CHCH2Cl,由反应信息可知,CH2=CHCH2Cl在催化剂条件下发生复分解反应生成CH2=CH2、ClCH2CH=CHCH2Cl,A在氢氧化钠水溶液、加热条件下发生反应生成C,故A为ClCH2CH=CHCH2Cl,B为CH2=CH2.B与溴发生加成反应生成H为BrCH2CH2Br,H在氢氧化钠水溶液、加热条件下发生取代反应生成I为HOCH2-CH2OH.A在氢氧化钠水溶液、加热条件下发生反应生成C为HOCH2CH=CHCH2OH,由J的结构可知,G为HOOC-CH=CH-COOH,由转化关系可知,结合反应④是C与HCl加成生成D,保护C=C不被氧化,D再氧化可得E,故D为HOCH2CH2CHClCH2OH,E为
解答 解:(1)丙烯中含有碳碳双键,在一定条件下能发生加聚反应生成聚丙烯,反应方程式为 ,
,
故答案为: ;
;
(2)根据反应原理可知,方法2比方法1原料比较丰富,能源消耗低,成本低,并且方法①中使用了有毒的HCN,而方法2比方法1降低了有毒气体的使用,减少了污染;
故答案为:生产成本低(原料易得、节能),无毒性;
(3)(i)反应①是CH2=CHCH3与氯气发生取代反应生成CH2=CHCH2Cl,反应⑥是卤代烃发生的消去反应,故答案为:取代反应;消去反应;加成反应;
(ii)反应④是C与HCl加成D,设计这一步反应的目的是保护分子中碳碳双键不被氧化,D再氧化可得E,故D为HOCH2CH2CHClCH2OH,E为

(iii)由上述分析可知,C的结构简式为HOCH2CH=CHCH2OH,属于酯类且属于甲酸酯的所有同分异构体的结构简式为HCOOCH2CH2CH3,HCOOCH(CH3)2,故答案为:HCOOCH2CH2CH3,HCOOCH(CH3)2.
点评 本题考查有机方程式的书写、物质制备实验方案设计的评价以及有机物的推断,需要学生对反应信息理解运用,注意推断中根据J的结构与转化关系中反应条件判断,注意掌握官能团的性质与转化,难度中等.

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案Ag2SO4(s)?Ag2O(s)+SO3(g),2SO3(g)?2SO2(g)+O2(g).反应经过10min后,测得c(SO3)=0.4mol•L-1,c(SO2)=0.1mol•L-1,则下列叙述中不正确的是( )
| A. | 容器里气体的密度为40g•L-1 | |
| B. | SO3的分解率为20% | |
| C. | 化学反应速率v(Ag2SO4)=v(SO3) | |
| D. | 在这10min内的平均反应速率为v(O2)=0.005mol•L-1•min-1 |
| A. | 电离平衡常数可以表示弱电解质的相对强弱 | |
| B. | 电离平衡常数受溶液浓度的影响 | |
| C. | H2CO3的电离常数表达式:K=$\frac{c({H}^{+})•c(C{O}_{3}^{2-})}{c({H}_{2}C{O}_{3})}$ | |
| D. | 电离常数大的酸溶液中c(H+)一定比电离常数小的酸中大 |
| 化学式 | CH3COOH | H2C2O4 | H2S |
| 电离平衡常数 | 1.8×10-5 | Ka1=5.4×10-2 Ka2=5.4×10-5 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
(1)H2S的一级电离常数表达式为Ka1=Ka1=$\frac{c({H}^{+}).c(H{S}^{-})}{c({H}_{2}S)}$
(2)CH3COOH、H2C2O4、H2S的酸性由强到弱的顺序H2C2O4>CH3COOH>H2S
(3)H2C2O4与少量的KOH溶液反应的化学方程式:H2C2O4+KOH═KHC2O4+H2O
(4)NaHS溶液与NaHC2O4溶液反应的离子方程式:HS-+HC2O4-═H2S+C2O42-
(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是③④ (填写序号).
①反应所需要的时间B>A
②开始反应时的速率A>B
③参加反应的锌的物质的量A=B
④反应过程的平均速率B>A
⑤B中有锌剩余.
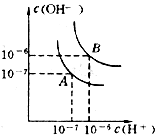 水的电离平衡线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点
水的电离平衡线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点