题目内容
6.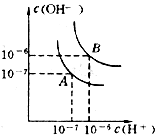 水的电离平衡线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点
水的电离平衡线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点(1)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃恒温,欲使混合溶液pH=7则Ba(OH)2与盐酸的体积比为2:9.
(2)室温时将PH为5的硫酸溶液稀释500倍,稀释后溶液中,C(SO42-)和C(H+)之比约为1:10.
分析 (1)设出氢氧化钡溶液、盐酸溶液的体积,然后根据溶液的pH列式计算出二者的体积比;
(2)稀释过程中硫酸的物质的量不变,当溶液接近中性时要考虑水的电离,所以将pH=5的硫酸溶液稀释500倍后,溶液中的SO42-与H+浓度的比值约为1:10.
解答 解:(1)设氢氧化钡容溶液的体积为xL,盐酸的体积为y,pH=8的Ba(OH)2溶液,溶液中c(OH-)=1×10-4mol/L,
pH=5的稀盐酸溶液中c(H+)=1×10-5mol/L,
欲使混合溶液pH=7,溶液此时显碱性,即混合后c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-7}}$mol/L=1×10-5mol/L,即$\frac{1{0}^{-4}x-1{0}^{-5}y}{x+y}$=1×10-5mol/L,解得x:y=2:9,
故答案为:2:9;
(2)pH为5的溶液中氢离子浓度为:c(H+)=1×10-5mol/L,硫酸根离子的浓度为:c(SO42-)=5×10-6mol/L,
溶液稀释500倍后,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,而硫酸根离子浓度为:c(SO42-)=1×10-8mol/L,
所以稀释后溶液中硫酸根离子与氢离子浓度之比为:1×10-8mol/L:1×10-7mol/L=1:10,
故答案为:1:10.
点评 本题考查了溶液酸碱性与溶液pH的关系及计算方法,为高频考点,题目难度中等,明确溶液酸碱性与溶液pH的关系,注意纯水中c(H+)=c(OH-),试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
16.实验室需配制一种仅含四种离子(不包括水电离出的离子)的混合溶液,且在混合液中四种离子的物质的量浓度均为0.5mol•L-1,下面四个选项中能达到此目的是( )
| A. | Fe2+、Na+、NO3-、Cl- | B. | Mg2+、NH4+、SO42-、NO3- | ||
| C. | H+、K+、Cl-、CH3COO- | D. | K+、Mg2+、CO32-、OH- |
17.下列离子方程式书写正确的是( )
| A. | Ca(ClO)2溶液中通入过量的二氧化硫气体:ClO-+SO2+H2O=HClO+HSO3- | |
| B. | 用高锰酸钾溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O | |
| C. | 稀硝酸中加入过量铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| D. | 向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- |
1.一定量的稀硫酸与足量的铝粉反应时,为了减缓反应速率,且不影响生成氢气的总量,应向稀硫酸中加入适量的( )
| A. | CH3COOK(固体) | B. | CH3COOH | C. | KCl(固体) | D. | KOH(固体) |
11.生活处处有化学,下列说法正确的是( )
| A. | 做衣服的棉、麻和丝分别属于纤维素、酯类和蛋白质 | |
| B. | 不锈钢餐具属于合金 | |
| C. | 在豆浆中加糖后碗底发现少量晶体状颗粒,这是蛋白质的盐析 | |
| D. | 水的硬度越大,用肥皂洗衣服时效果越好 |
18.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下,4.4g乙醛所含σ键数目为0.7 NA | |
| C. | 标准状况下,5.6L CO2与足量Na2O2反应转移的电子数为0.5 NA | |
| D. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3 NA |
15.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 在标准状况下,22.4LCCl4中含5 NA个原子 | |
| B. | 0.1mol铁与足量的盐酸完全反应,铁失去的电子数为0.1 NA | |
| C. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1 NA | |
| D. | 将100mL0.1mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.01 NA |
13. 一定条件下存在反应C(s)+H2O(g)?C O(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示.则下列说法正确的是( )
一定条件下存在反应C(s)+H2O(g)?C O(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示.则下列说法正确的是( )
 一定条件下存在反应C(s)+H2O(g)?C O(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示.则下列说法正确的是( )
一定条件下存在反应C(s)+H2O(g)?C O(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示.则下列说法正确的是( )| 容 器 | 甲 | 乙 | 丙 |
| 容 积 | 0.5L | 0.5L | V |
| 温 度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2molC 1molH2O | 1molCO 1molH2 | 4molC 2molH2O |
| A. | 甲容器中,反应在前15min的平均速率v(H2)=0.2mol•L-1•min-1 | |
| B. | 丙容器的体积V>0.5L | |
| C. | 当温度为T1℃时,反应的平衡常数K=4.5(mol•L-1) | |
| D. | 乙容器中,若平衡时n(H2O)=0.4mol,则T1<T2 |
 .
. 两边基团换位的反应.如两个丙烯分子进行烯烃换位,生成丁烯和乙烯.
两边基团换位的反应.如两个丙烯分子进行烯烃换位,生成丁烯和乙烯. +H2O
+H2O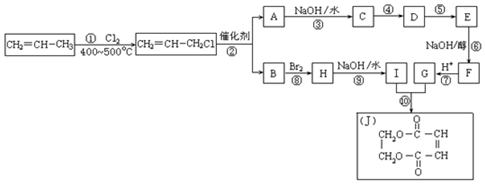
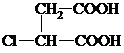 .
.