题目内容
1.研究CO2、CO的利用对促进低碳社会的构建具有重要意义,CO2、CO都可用于合成甲醇.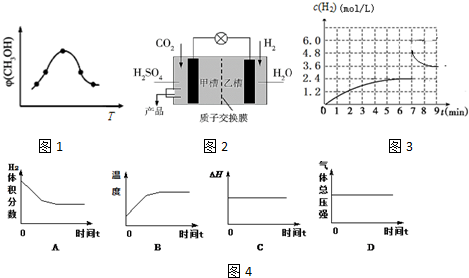
(1)CO2用于合成甲醇的热化学方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H
①该反应的平衡常数表达式为K=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}(H)}$.
②取一定体积CO2和H2的混合气体(物质的量之比为1:3),加入恒容密闭容器中发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如1图所示,则该反应的△H<0(填“>”、“<”或“=”).
③科学家现正研发的以实现CO2转化为甲醇在常温常压下进行的装置如图2所示,写出甲槽的电极反应式CO2+6e-+6H+=CH3OH+H2O.
(2)CO用于合成甲醇的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H,在压强为0.1MPa、温度为300℃条件下,将a mol CO与2a mol H2的混合气体在催化剂作用下发生下面反应2生成甲醇,下列图象如图4正确且说明可逆反应达到平衡状态的是AB.(填序号)
(3)以CH4和H2O为原料,也可通过下列反应1和反应2来制备甲醇.
反应1:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.0kJ•mol-1
反应2:CO(g)+2H2(g)?CH3OH(g)△H=-129.0kJ•mol-1
①CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77kJ•mol-1.
②已知:在700℃,1MPa时,1mol CH4与1mol H2O在1L密闭容器中发生反应1,6min达到平衡(如图3),此时CH4的转化率为80%.根据图3分析,由第一次平衡到第二次平衡,平衡向逆反应方向移动(填“正反应”或“逆反应”),采取的措施可能是将容器体积缩小为原来的$\frac{1}{2}$或加入等量的氢气.
分析 (1)①平衡常数等于生成物的浓度系数次幂之积除以反应物浓度系数次幂之积;
②根据温度对平衡移动的影响判断反应热的符号;
③甲槽为CO2得电子发生还原反应生成CH3OH,据此书写反应式;
(2)根据平衡状态的本质和表观现象分析;
(3)①根据盖斯定律:1:CH4 (g)+H2O (g)=CO (g)+3H2 (g)△H=+206.0kJ•mol-1
2:CO (g)+2H2 (g)=CH3OH (g)△H=-129.0kJ•mol-1
依据盖斯定律,1+2得到要书写的热化学方程式.
②CH4(g)+H2O(g)$?_{催化剂}^{高温}$CO2(g)+3H2(g)
起始(mol/L):1 1 0 0
变化(mol/L):0.8 0.8 0.8 2.4
平衡(mol/L):0.2 0.2 0.8 2.4
此时CH4的转化率为$\frac{0.8}{1}$×100%=80%;
由图3可知,在7min时,氢气的浓度增大了一倍,可能是缩小体积为原来的$\frac{1}{2}$或增加了等量的氢气,平衡均是逆向移动.
解答 解:(1)①二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),其平衡常数K=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}(H)}$,
故答案为:$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}(H)}$;
②根据图象可知达到平衡后,温度越高,甲醇的体积分数φ(CH3OH)越小,说明升高温度平衡逆移,则正反应方向为放热反应,则△H<0,
故答案为:<;
③根据图2,甲槽为CO2得电子发生还原反应生成CH3OH,反应式为CO2+6e-+6H+═CH3OH+H2O,
故答案为:CO2+6e-+6H+═CH3OH+H2O;
(2)A.在一定的时间后,氢气含量不变为平衡状态,故A正确;
B..在一定的时间后,温度不变为平衡状态,故B正确;
C.反应的焓变与反应是否达平衡无关,故C错误;
D.反应条件为恒压,故压强不变不能判断反应是否达平衡,故D错误.
故答案为:AB;
(3)①根据盖斯定律:1:CH4 (g)+H2O (g)=CO (g)+3H2 (g)△H=+206.0kJ•mol-1
2:CO (g)+2H2 (g)=CH3OH (g)△H=-129.0kJ•mol-1
依据盖斯定律,1+2得到:CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77kJ•mol-1,
故答案为:CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77kJ•mol-1;
②CH4(g)+H2O(g)$?_{催化剂}^{高温}$CO2(g)+3H2(g)
起始(mol/L):1 1 0 0
变化(mol/L):0.8 0.8 0.8 2.4
平衡(mol/L):0.2 0.2 0.8 2.4
此时CH4的转化率为$\frac{0.8}{1}$×100%=80%;
由图3可知,在7min时,氢气的浓度增大了一倍,可能是缩小体积为原来的$\frac{1}{2}$或增加了等量的氢气,无论是增大压强,还是增大氢气的浓度,平衡均是逆向移动,
故答案为:80%;逆反应;将容器体积缩小为原来的$\frac{1}{2}$或加入等量的氢气.
点评 本题考查了盖斯定律的应用、化学平衡影响因素和化学平衡常数以及转化率的计算、燃料电池的电极反应式的书写,综合性较强,为历年高考高频考点,侧重于化学反应原理和图象分析能力的培养,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 在标准状况下,22.4LCCl4中含5 NA个原子 | |
| B. | 0.1mol铁与足量的盐酸完全反应,铁失去的电子数为0.1 NA | |
| C. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1 NA | |
| D. | 将100mL0.1mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.01 NA |
| A. | 某溶液中滴加AgNO3溶液有白色沉淀,说明原溶液中有Cl- | |
| B. | 某溶液中先滴足量盐酸无现象,再滴加BaCl2溶液有白色沉淀,说明原溶液中有SO42- | |
| C. | 某溶液中滴加NaOH溶液有蓝色沉淀,说明原溶液中有Fe3+ | |
| D. | 某溶液中滴加稀硫酸生成无色气体,说明原溶液中有CO32- |
 CO2是一种温室气体,据科学家预测,到21世纪中叶,全球气温将升高1.5-4.5℃,地球气温的升高会引起海平面升高,对人类的生存环境产生巨大的影响.如何合理地利用CO2是摆在科学家面前的一个重大课题.回答下列问题:
CO2是一种温室气体,据科学家预测,到21世纪中叶,全球气温将升高1.5-4.5℃,地球气温的升高会引起海平面升高,对人类的生存环境产生巨大的影响.如何合理地利用CO2是摆在科学家面前的一个重大课题.回答下列问题:(1)工业上利用高温、高压条件,可用CO2与NH3合成尿素[CO(NH2)2],该反应的化学方程式为CO2+NH3 $\frac{\underline{\;高温高压\;}}{\;}$CO(NH2)2+H2O.
(2)一定条件下,不同量的CO2与不同量的NaOH充分反应放出的热景如下表所示:
| CO2的量 | NaOH溶液的量 | 放出的热量 | |
| ① | 22.0g | 750mL1.0mol•L-1 | xkJ |
| ② | 1.0mol | 2.0mL1.0mol•L-1 | ykJ |
(3)在一定温度和催化剂作用下,可将CO2转化为燃料CH4,反应方程式为CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H. 300℃时,一定量的CO2和H2混合气体在容积为2L的恒容密闭容
器中发生上述反应,5min后达到平衡,此时各物质的浓度如下表:
| 物质 | CO2(g) | H2(g) | CH4(g) | H2O(g) |
| 浓度/mol•L-1 | 0.2 | 0.8 | a | 1.6 |
(4)CO2还可用于生产甲醇,一定条件下,发生反应CO2 (g)+3H(g)?CH3OH(g)+H2O(g)△H.①在容积为2L的恒容密闭容器中,通入2molCO2和3mol H2发生上述反应,下铡碳法能够表明该可逆反应达到平衡状态的是de(填字母).
a.消耗3mol H2(g)时,有lmol CH3OH(g)生成
b.转移3mol电子时,反应的CO2为11.2L(标准状况)
c.体系中气体的密度不变
d.水蒸气的体积分数保持不变
e.单位时间内生成H2(g)与生成H2O(g)的物质的量之比为3:1
②用多孔石墨作电极,30% KOH溶液作电解质溶液,可设计如图甲所示的甲醇燃料电池,该电池的负极反应式为CH3OH-6e-+8OH-═CO32-+6H2O.若将该燃料电池与电解饱和食盐水的装置进行串联(如图),当有0.12mol电子发生转移时,断开电源,将溶液冷却至室温,测得食盐溶液为120mL,则此时乙装置中溶液的pH=14假设食盐水中有足量的NaCl,且Cl2完全逸出).
 一定条件下存在反应C(s)+H2O(g)?C O(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示.则下列说法正确的是( )
一定条件下存在反应C(s)+H2O(g)?C O(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示.则下列说法正确的是( )| 容 器 | 甲 | 乙 | 丙 |
| 容 积 | 0.5L | 0.5L | V |
| 温 度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2molC 1molH2O | 1molCO 1molH2 | 4molC 2molH2O |
| A. | 甲容器中,反应在前15min的平均速率v(H2)=0.2mol•L-1•min-1 | |
| B. | 丙容器的体积V>0.5L | |
| C. | 当温度为T1℃时,反应的平衡常数K=4.5(mol•L-1) | |
| D. | 乙容器中,若平衡时n(H2O)=0.4mol,则T1<T2 |
| A. | 容器Ⅰ、Ⅱ中正反应速率相同 | |
| B. | 容器Ⅰ中的气体颜色比容器Ⅱ中的气体颜色深 | |
| C. | 容器Ⅰ、Ⅲ中反应的平衡常数相同 | |
| D. | 容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化率之和等于1 |
 .
. 两边基团换位的反应.如两个丙烯分子进行烯烃换位,生成丁烯和乙烯.
两边基团换位的反应.如两个丙烯分子进行烯烃换位,生成丁烯和乙烯. +H2O
+H2O
 .
.