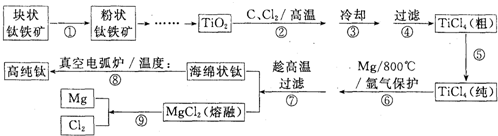
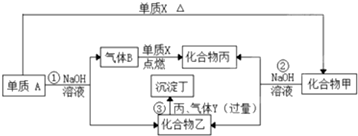
题目内容
有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:(1)第一份加入AgNO3溶液有沉淀产生.(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,以下推测错误的是( )
| A、K+一定存在 |
| B、每份取样溶液中含0.02mol CO32- |
| C、Cl-可能存在 |
| D、Ba2+一定不存在,Mg2+可能存在 |
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:第二份足量NaOH溶液加热后,收集到气体0.04mol,说明溶液中有NH4+其物质的量为0.04mol,第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量减小,说明原来有CO32-,则原溶液中没有Mg2+、Ba2+,沉淀没有完全溶解,说明原溶液中有SO42-,且BaSO4的质量为2.33g,则说明原溶液中SO42-的物质的量为0.01mol,BaCO3的质量为6.27g-2.33g=3.94g,为0.02mol,据此答题.
解答:
解:第二份足量NaOH溶液加热后,收集到气体0.04mol,说明溶液中有NH4+其物质的量为0.04mol,第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量减小,说明原来有CO32-,则原溶液中没有Mg2+、Ba2+,沉淀没有完全溶解,说明原溶液中有SO42-,且BaSO4的质量为2.33g,则说明原溶液中SO42-的物质的量为0.01mol,BaCO3的质量为6.27g-2.33g=3.94g,为0.02mol,则CO32-为0.02mol,
A、因为溶液中NH4+为0.04mol,SO42-为0.01mol,CO32-为0.02mol,根据电荷守恒可知,溶液中至少还有0.02molK+,故A正确;
B、BaCO3的质量为6.27g-2.33g=3.94g,为0.02mol,则CO32-为0.02mol,故B正确;
C、第一份加入AgNO3溶液有沉淀产生,说明溶液中可能有Cl-,也可能没有,沉淀可由CO32-或SO42-与AgNO3溶液反应产生,故C正确;
D、因为加入足量BaCl2溶液后,足量盐酸洗涤,沉淀部分溶解,则说明原溶液中一定存在Ba2+和Mg2+,故D错误;
故选D.
A、因为溶液中NH4+为0.04mol,SO42-为0.01mol,CO32-为0.02mol,根据电荷守恒可知,溶液中至少还有0.02molK+,故A正确;
B、BaCO3的质量为6.27g-2.33g=3.94g,为0.02mol,则CO32-为0.02mol,故B正确;
C、第一份加入AgNO3溶液有沉淀产生,说明溶液中可能有Cl-,也可能没有,沉淀可由CO32-或SO42-与AgNO3溶液反应产生,故C正确;
D、因为加入足量BaCl2溶液后,足量盐酸洗涤,沉淀部分溶解,则说明原溶液中一定存在Ba2+和Mg2+,故D错误;
故选D.
点评:本题主要考查了常见离子的共存问题,中等难度,解题的难点在于根据离子的物质的量,利用电荷守恒判断钾离子的存在.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法正确的是( )
| A、CO(g)的燃烧热:△H=-283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0kJ/mol |
| B、已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ?mol-1,则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出57.3kJ的热量 |
| C、己知2C(s)+2O2(g)=2CO2(g)△H=a;2C(s)+O2(g)=2CO(g);△H=b,则a>b |
| D、已知C (石墨,s)=C (金刚石,s)△H>0,则石墨比金刚石稳定 |
下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )
| A、向干燥红色布条中滴加新制氯水,红色布条会褪色(HCl) |
| B、向NaHCO3固体中加入新制氯水,有无色气泡产生(H+) |
| C、将AgNO3溶液滴加到新制氯水中,有白色沉淀产生(Cl-) |
| D、向FeCl2溶液中滴加新制氯水,再滴加KSCN溶液,溶液呈红色(Cl2) |
如图是关于N2+3H2?2NH3△H<0的速率-时间图象,则t1时刻使平衡发生移动的原因是( )

| A、升高温度,同时增大压强 |
| B、降低温度,同时减小压强 |
| C、增大反应物的浓度,同时使用适宜的催化剂 |
| D、增大反应物的浓度,同时减小生成物的浓度 |
25℃时,合成氨反应N2(g)+3H2(g)═2NH3(g)△H=92KJ?mol,将此温度下的1mol N2和3mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为23KJ(假定测量过程中没有能量损失),则N2的转化率为( )
| A、25% | B、50% |
| C、75% | D、无法确定 |
AgCl和Ag2CrO4的溶度积分别为1.8×10-10 mol2?L-2和2.0×10-12 mol3?L-3,若用难溶盐在溶液中的浓度来表示其溶解度,则下面的叙述中正确的是( )
| A、AgCl和Ag2CrO4的溶解度相等 |
| B、AgCl的溶解度大于Ag2CrO4的溶解度 |
| C、两者类型不同,不能由Ksp的大小直接判断溶解能力的大小 |
| D、都是难溶盐,溶解度无意义 |
 已知一定温度和压强下,在容积为VL的密闭容器中充入1molA和1molB,保持恒温恒压下反应:A(g)+B(g)?C(g)△H<0.达到平衡时,C的体积分数为40%.试回答有关问题:
已知一定温度和压强下,在容积为VL的密闭容器中充入1molA和1molB,保持恒温恒压下反应:A(g)+B(g)?C(g)△H<0.达到平衡时,C的体积分数为40%.试回答有关问题: