题目内容
 (NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.实验步骤如下:
(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.实验步骤如下:①称取约2.5000g叠氮化钠试样,配成250mL溶液.
②准确量取25.00mL溶液置于锥形瓶中,用滴定管加入50.00mL 0.1000mol?L-1
(NH4)2Ce(NO3)6(六硝酸铈铵),
[发生反应为:)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑](杂质不参与反应).
③反应后将溶液稍稀释,然后向溶液中加入 5mL浓硫酸,滴入2滴邻菲哕啉指示液,用0.0500mol?L-1(NH4)2Fe(SO4)2(硫酸亚铁铵)标准滴定溶液滴定过量的Ce4+至溶液由淡绿色变为黄红色(发生的反应为:Ce4++Fe2+=Ce3++Fe3+),消耗硫酸亚铁铵标准溶液24.00mL.
(1)步骤①配制叠氮化钠溶液时,除需用到烧杯、玻璃棒、量筒外,还用到的玻璃仪器有
(2)叠氮化钠受撞击时生成两种单质,反应的化学方程式为
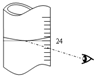
(3)若其它读数正确,滴定到终点后,读取滴定管中 (NH4)2Fe(SO4)2标准溶液体积按右图图示读取,将导致所测定样品中叠氮化钠质量分数
(4)通过计算确定叠氮化钠试样中含NaN3的质量分数为多少(写出计算过程)
考点:探究物质的组成或测量物质的含量
专题:
分析:(1)依据溶液配制的实验工厂和步骤分析需要的仪器;
(2)叠氮化钠受撞击时生成两种单质为氮气和钠;
(3)读取滴定管中 (NH4)2Fe(SO4)2标准溶液体积按右图图示读取,读数增大,计算过程中剩余铈离子物质的量增大,则叠氮化钠的物质的量减小;
(4)计算n[(NH4)2Ce(NO3)6],n[(NH4)2Fe(SO4)2],结合滴定过程,叠氮化钠和六硝酸铈铵反应,剩余的六硝酸铈铵,加入浓硫酸铁红为Ce4+,用0.0500mol?L-1(NH4)2Fe(SO4)2(硫酸亚铁铵)标准滴定溶液滴定过量的Ce4+,结合化学方程式定量关系计算;
(2)叠氮化钠受撞击时生成两种单质为氮气和钠;
(3)读取滴定管中 (NH4)2Fe(SO4)2标准溶液体积按右图图示读取,读数增大,计算过程中剩余铈离子物质的量增大,则叠氮化钠的物质的量减小;
(4)计算n[(NH4)2Ce(NO3)6],n[(NH4)2Fe(SO4)2],结合滴定过程,叠氮化钠和六硝酸铈铵反应,剩余的六硝酸铈铵,加入浓硫酸铁红为Ce4+,用0.0500mol?L-1(NH4)2Fe(SO4)2(硫酸亚铁铵)标准滴定溶液滴定过量的Ce4+,结合化学方程式定量关系计算;
解答:
解:(1)步骤①配制叠氮化钠溶液时,除需用到烧杯、玻璃棒、量筒外,还用到的玻璃仪器有,250mL容量瓶、胶头滴管;
故答案为:250mL容量瓶、胶头滴管;
(2)叠氮化钠受撞击时生成两种单质,反应的化学方程式为:2NaN3
2Na+3N2↑;
故答案为:2NaN3
2Na+3N2↑;
(3)读取滴定管中 (NH4)2Fe(SO4)2标准溶液体积按右图图示读取,读数增大,计算过程中剩余铈离子物质的量增大,则叠氮化钠的物质的量减小;
故答案为:偏小;
(4)计算n[(NH4)2Ce(NO3)6],n[(NH4)2Fe(SO4)2],结合滴定过程,叠氮化钠和六硝酸铈铵反应,剩余的六硝酸铈铵,加入浓硫酸铁红为Ce4+,用0.0500mol?L-1(NH4)2Fe(SO4)2(硫酸亚铁铵)标准滴定溶液滴定过量的Ce4+,结合化学方程式定量关系计算;
n[(NH4)2Ce(NO3)6]=0.1000mol?L-1×50.00×10-3L=5.000×10-3mol
n[(NH4)2Fe(SO4)2]=0.0500mol?L-1×24.00×10-3L=1.200×10-3molw
与NaN3反应的n[(NH4)2Ce(NO3)6]=5.000×10-3mol-1.200×10-3mol
=3.800×10-3mol
ω=
×100%=98.80%;
答:叠氮化钠试样中含NaN3的质量分数为98.80%;
故答案为:250mL容量瓶、胶头滴管;
(2)叠氮化钠受撞击时生成两种单质,反应的化学方程式为:2NaN3
| ||
故答案为:2NaN3
| ||
(3)读取滴定管中 (NH4)2Fe(SO4)2标准溶液体积按右图图示读取,读数增大,计算过程中剩余铈离子物质的量增大,则叠氮化钠的物质的量减小;
故答案为:偏小;
(4)计算n[(NH4)2Ce(NO3)6],n[(NH4)2Fe(SO4)2],结合滴定过程,叠氮化钠和六硝酸铈铵反应,剩余的六硝酸铈铵,加入浓硫酸铁红为Ce4+,用0.0500mol?L-1(NH4)2Fe(SO4)2(硫酸亚铁铵)标准滴定溶液滴定过量的Ce4+,结合化学方程式定量关系计算;
n[(NH4)2Ce(NO3)6]=0.1000mol?L-1×50.00×10-3L=5.000×10-3mol
n[(NH4)2Fe(SO4)2]=0.0500mol?L-1×24.00×10-3L=1.200×10-3molw
与NaN3反应的n[(NH4)2Ce(NO3)6]=5.000×10-3mol-1.200×10-3mol
=3.800×10-3mol
ω=
| 3.800×10-3mol×65g/mol | ||
2.5000g×
|
答:叠氮化钠试样中含NaN3的质量分数为98.80%;
点评:本题考查了物质组成的实验探究和定量测定方法,过程分析判断,主要是试剂反应过程的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
下列实验操作过程能引起结果偏高的是( )
①用已知浓度的盐酸滴定未知浓度的NaOH溶液时,酸式滴定管未用标准液润洗.
②用量筒量取5.0mL溶液时,俯视读数.
③配制一定物质的量浓度的硫酸溶液,定容时仰视容量瓶的刻度线.
④用已知浓度的盐酸滴定未知浓度的NaOH溶液时,滴定前平视读数,滴定终点仰视读数.
①用已知浓度的盐酸滴定未知浓度的NaOH溶液时,酸式滴定管未用标准液润洗.
②用量筒量取5.0mL溶液时,俯视读数.
③配制一定物质的量浓度的硫酸溶液,定容时仰视容量瓶的刻度线.
④用已知浓度的盐酸滴定未知浓度的NaOH溶液时,滴定前平视读数,滴定终点仰视读数.
| A、③④ | B、②③ | C、①④ | D、①② |
下列有关化学实验的叙述正确的是( )
| A、用待测液润洗滴定用的锥形瓶 |
| B、配制FeCl3溶液时,向溶液中加入少量Fe和稀盐酸 |
| C、用稀硝酸酸洗涤盛做过银镜反应的试管 |
| D、液溴保存时液面覆盖一层水,装在带橡胶塞的试剂瓶中 |
下列装置或操作能达到实验目的是( )
A、 检查装置气密性 |
B、 从碘的CCl4溶液中分离出碘 |
C、 除去甲烷中乙烯 |
D、 分离甲苯与乙醇 |
常温下,下列有关说法中不正确的是( )
| A、amol?L-元酸HA溶液与bmol?L-1NaOH溶液等体积混合后,若pH为7,则c(A-)=c(Na+) |
| B、在Kw/c(H+)=0.1mol?L-l的溶液中,Na+、K+、CO32-、NO3-能大量共存 |
| C、将等浓度等体积的Na2CO3溶液、CH3COONa溶液、NaOH溶液稀释相同倍数,pH变化最大的是CH3COONa溶液 |
| D、25℃时氢氧化钠滴定二元弱酸H2R水溶液,得到含有H2R、HR-、R2-三种微粒的溶液,当c(Na+)=c(R2-)+c(HR-)+c(H2R)时溶液的溶质为NaHR |
 A、B、M、D、E是原子序数依次增大的五种短周期元素.A元素的一种原子中不含中子.B、M、D、E分别在下表(周期表的一部分)不同的空格内占有相应的位置,E的原子序数是D的原子序数的2倍.试回答:
A、B、M、D、E是原子序数依次增大的五种短周期元素.A元素的一种原子中不含中子.B、M、D、E分别在下表(周期表的一部分)不同的空格内占有相应的位置,E的原子序数是D的原子序数的2倍.试回答: