题目内容
 A、B、M、D、E是原子序数依次增大的五种短周期元素.A元素的一种原子中不含中子.B、M、D、E分别在下表(周期表的一部分)不同的空格内占有相应的位置,E的原子序数是D的原子序数的2倍.试回答:
A、B、M、D、E是原子序数依次增大的五种短周期元素.A元素的一种原子中不含中子.B、M、D、E分别在下表(周期表的一部分)不同的空格内占有相应的位置,E的原子序数是D的原子序数的2倍.试回答:(1)A元素是
(2)在B、M、D、E四种元素的最简单氢化物中,沸点最高的是
(3)A、B、M、D可组成多种18电子分子,写出2种具有18电子的有机物的结构简式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A元素的一种原子中不含中子,则A为H元素;B、M、D、E的原子序数依次增大,则其相对位置为: ,E的原子序数是D的原子序数的2倍,则D为O元素、E为S元素、M为N元素、B为C元素,即:A为H、B为C、M为N、D为O、E为S元素,据此进行解答.
,E的原子序数是D的原子序数的2倍,则D为O元素、E为S元素、M为N元素、B为C元素,即:A为H、B为C、M为N、D为O、E为S元素,据此进行解答.
 ,E的原子序数是D的原子序数的2倍,则D为O元素、E为S元素、M为N元素、B为C元素,即:A为H、B为C、M为N、D为O、E为S元素,据此进行解答.
,E的原子序数是D的原子序数的2倍,则D为O元素、E为S元素、M为N元素、B为C元素,即:A为H、B为C、M为N、D为O、E为S元素,据此进行解答.解答:
解:A元素的一种原子中不含中子,则A为H元素;B、M、D、E的原子序数依次增大,则其相对位置为: ,E的原子序数是D的原子序数的2倍,则D为O元素、E为S元素、M为N元素、B为C元素,即:A为H、B为C、M为N、D为O、E为S元素,
,E的原子序数是D的原子序数的2倍,则D为O元素、E为S元素、M为N元素、B为C元素,即:A为H、B为C、M为N、D为O、E为S元素,
(1)A元素是氢或H,
故答案为:氢(或H);
(2)B、M、D、E四种元素的最简单氢化物都是分子晶体,分子之间以分子间作用力结合,分子间作用力越大,克服分子间作用力使物质融化或汽化消耗的能量就越多,物质的熔沸点就越高,而分子间作用力与物质的相对分子质量有关,物质的相对分子质量越大,分子间作用力就越大,熔沸点也就越高,但是在水分子之间、氨气的分子之间还都存在着氢键,增加了分子之间的相互作用,由于氢键:H2O>NH3,则沸点H2O>NH3,所以在B、M、D、E四种元素的最简单氢化物中,沸点最高的是H2O,
故答案为:H2O;
(3)A为H、B为C、M为N、D为O元素,A、B、M、D可组成有18电子有机物的结构简式为:CH3-CH3、CH3OH、CH3NH2等,
故答案为:CH3-CH3;CH3OH(或CH3NH2均可).
 ,E的原子序数是D的原子序数的2倍,则D为O元素、E为S元素、M为N元素、B为C元素,即:A为H、B为C、M为N、D为O、E为S元素,
,E的原子序数是D的原子序数的2倍,则D为O元素、E为S元素、M为N元素、B为C元素,即:A为H、B为C、M为N、D为O、E为S元素,(1)A元素是氢或H,
故答案为:氢(或H);
(2)B、M、D、E四种元素的最简单氢化物都是分子晶体,分子之间以分子间作用力结合,分子间作用力越大,克服分子间作用力使物质融化或汽化消耗的能量就越多,物质的熔沸点就越高,而分子间作用力与物质的相对分子质量有关,物质的相对分子质量越大,分子间作用力就越大,熔沸点也就越高,但是在水分子之间、氨气的分子之间还都存在着氢键,增加了分子之间的相互作用,由于氢键:H2O>NH3,则沸点H2O>NH3,所以在B、M、D、E四种元素的最简单氢化物中,沸点最高的是H2O,
故答案为:H2O;
(3)A为H、B为C、M为N、D为O元素,A、B、M、D可组成有18电子有机物的结构简式为:CH3-CH3、CH3OH、CH3NH2等,
故答案为:CH3-CH3;CH3OH(或CH3NH2均可).
点评:本题考查了位置结构与性质的关系,题目难度中等,正确判断各元素名称为解答关键,注意掌握原子结构与元素周期表、元素周期律的关系,试题侧重基础知识的考查,有利于培养学生综合应用所学知识的能力.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案
相关题目
仅用下表提供的仪器(夹持仪器和试剂任选)不能达到相应实验目的是( )
| A、用盐酸除去BaSO4中混有的少量BaCO3 漏斗,烧杯、玻璃棒、胶头滴管、滤纸 |
| B、从食盐水中获得NaCl晶体酒精灯、玻璃棒、坩埚、泥三角 |
| C、用0.l0mol?L-1的盐酸测定未知浓度的NaOH溶液 碱式滴定管、酸式滴定管、锥形瓶、烧杯 |
| D、用溴水和CCl4除去NaBr溶液中少量NaI 烧杯、玻璃棒、胶头滴管、分液漏斗 |
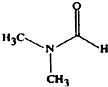 淮南市煤炭年产量已达到1忆吨以上,是我国13个忆吨煤炭生产基地之一.二甲基甲酰胺(C3H7NO)是以煤炭为原料的重要化工产品之一,其结构如图所示,下列关于二甲基甲酰胺的说法不正确的是( )
淮南市煤炭年产量已达到1忆吨以上,是我国13个忆吨煤炭生产基地之一.二甲基甲酰胺(C3H7NO)是以煤炭为原料的重要化工产品之一,其结构如图所示,下列关于二甲基甲酰胺的说法不正确的是( )| A、元素电负性大小为:O>N>C |
| B、B二甲基甲酰胺分子中既含有极性键又含有非极性键 |
| C、二甲基酰胺具有还原性,在化学反应中长做还原剂 |
| D、在空气中完全燃烧73g二甲基甲酰胺可以得到标准状况下67.2LCO2 |
化学与生活密切相关,下列说法正确的是( )
| A、碘是人体必需的微量元素,所以要多吃富含高碘酸的食物 |
| B、为了增加食物的营养成分,可以大量使用食品添加剂 |
| C、聚乙烯塑料的老化是由于发生了加成反应 |
| D、粮食酒主要经过了淀粉→葡萄糖→乙醇的化学变化过程 |




 .
.

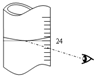 (NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.实验步骤如下:
(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.实验步骤如下: