题目内容
下列实验操作、现象与结论对应关系正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol/L H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
| B | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出Na2CO3晶体 |
| C | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,排水法收集气体 | HX放出的氢气多且反应速率快 | HX酸性比HY弱 |
| D | 先向2mL0.1mol/LNa2S溶液中滴几滴0.1mol/LZnSO4溶液,再加入几滴0.1mol/LCuSO4溶液 | 开始有白色沉淀生成;后又有黑色沉淀生成 | Ksp(ZnS)<Ksp(CuS) |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.试管口出现红棕色气体,为一氧化氮与氧气反应生成红棕色的二氧化氮;
B.碳酸氢钠的溶解度比碳酸钠的溶解度小;
C.等体积pH=2的HX和HY两种酸,HX放出的氢气多,则HX浓度大;
D.依据沉淀转化的实质分析判断.
B.碳酸氢钠的溶解度比碳酸钠的溶解度小;
C.等体积pH=2的HX和HY两种酸,HX放出的氢气多,则HX浓度大;
D.依据沉淀转化的实质分析判断.
解答:
解:A.在酸性条件下,Fe2+与NO3-发生氧化还原反应,3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,对于该反应Fe2+为还原剂,NO3-为氧化剂,被还原成NO,试管口出现红棕色气体,为一氧化氮与氧气反应生成红棕色的二氧化氮,故A错误;
B.碳酸氢钠的溶解度比碳酸钠的溶解度小,向Na2CO3饱和溶液中通入足量CO2,Na2CO3与CO2反应生成NaHCO3,所以会析出NaHCO3,故B错误;
C.等体积pH=2的HX和HY两种酸,HX放出的氢气多,则HX浓度大大,所以HX的酸性弱,故C正确;
D.向Na2S溶液中滴入ZnSO4溶液有白色沉淀生成,再加入几滴CuSO4溶液,沉淀由白色转化为黑色,硫化锌和硫化铜阴阳离子比相同,说明溶度积(Ksp):ZnS>CuS,故D错误.
故选C.
B.碳酸氢钠的溶解度比碳酸钠的溶解度小,向Na2CO3饱和溶液中通入足量CO2,Na2CO3与CO2反应生成NaHCO3,所以会析出NaHCO3,故B错误;
C.等体积pH=2的HX和HY两种酸,HX放出的氢气多,则HX浓度大大,所以HX的酸性弱,故C正确;
D.向Na2S溶液中滴入ZnSO4溶液有白色沉淀生成,再加入几滴CuSO4溶液,沉淀由白色转化为黑色,硫化锌和硫化铜阴阳离子比相同,说明溶度积(Ksp):ZnS>CuS,故D错误.
故选C.
点评:本题考查化学实验方案的评价,为高频考点,涉及氧化还原反应、酸性比较及电离、沉淀的转化等知识,把握实验操作及物质的性质为解答的关键,注意方案的合理性、操作性分析,题目难度不大.

练习册系列答案
相关题目
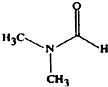 淮南市煤炭年产量已达到1忆吨以上,是我国13个忆吨煤炭生产基地之一.二甲基甲酰胺(C3H7NO)是以煤炭为原料的重要化工产品之一,其结构如图所示,下列关于二甲基甲酰胺的说法不正确的是( )
淮南市煤炭年产量已达到1忆吨以上,是我国13个忆吨煤炭生产基地之一.二甲基甲酰胺(C3H7NO)是以煤炭为原料的重要化工产品之一,其结构如图所示,下列关于二甲基甲酰胺的说法不正确的是( )| A、元素电负性大小为:O>N>C |
| B、B二甲基甲酰胺分子中既含有极性键又含有非极性键 |
| C、二甲基酰胺具有还原性,在化学反应中长做还原剂 |
| D、在空气中完全燃烧73g二甲基甲酰胺可以得到标准状况下67.2LCO2 |
用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列操作会引起测定结果偏高的是( )
(1)滴定时,装待测溶液的锥形瓶有少量水;(2)酸式滴定管用蒸馏水洗后,未用标准溶液洗;(3)滴定终点读数时,仰视刻度线.
(1)滴定时,装待测溶液的锥形瓶有少量水;(2)酸式滴定管用蒸馏水洗后,未用标准溶液洗;(3)滴定终点读数时,仰视刻度线.
| A、只有(1) |
| B、只有(2) |
| C、(2)(3) |
| D、(1)(2)(3) |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、使甲基橙变红色的溶液:Al3+、Cu2+、I-、S2O32- | ||
B、常温下,加水冲稀时
| ||
| C、0.1mol?L-1Fe(NO3)2溶液:[Fe(CN)6]3+、Na+、SO42-、Cl- | ||
| D、0.1mol?L-1 NaAlO2溶液:NH4+、K+、HCO3-、SO32- |
 (NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.实验步骤如下:
(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.实验步骤如下:
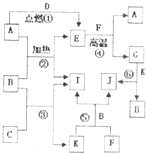 如图是中学化学常见物质之间的转换关系,其中A、C、D、F、I为单质,其余为化合物,C和D在点燃或者加热的条件下生成淡黄色的固体,B常温下为液态.试回答下列有关问题:
如图是中学化学常见物质之间的转换关系,其中A、C、D、F、I为单质,其余为化合物,C和D在点燃或者加热的条件下生成淡黄色的固体,B常温下为液态.试回答下列有关问题: