题目内容
短周期元素A、B、C、D、E的原子序数依次增大,A元素阳离子的原子核外没有电子,B是空气中含量最多的元素;C元素原子最外层电子数是其电子层数的三倍;C与D可形成两种常见的离子化合物;工业上常用电解C与E的化合物来制备E单质.
(1)画出D元素的原子结构示意图 .C、D、E的简单离子半径由小到大的顺序( 用离子符号表示) .
(2)工业上常用A和B的单质合成一种常见气体,该气体的电子式 .检验该气体的常用方法是 .
(3)D2C2与H2O反应的化学方程式是 ,D2C2与CuSO4溶液反应的现象是 .
(4)A、B、C三种元素可组成一种常见离子化合物,其水溶液呈酸性,该溶液中离子浓度由大到小的顺序是 .
(1)画出D元素的原子结构示意图
(2)工业上常用A和B的单质合成一种常见气体,该气体的电子式
(3)D2C2与H2O反应的化学方程式是
(4)A、B、C三种元素可组成一种常见离子化合物,其水溶液呈酸性,该溶液中离子浓度由大到小的顺序是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:短周期元素A、B、C、D、E的原子序数依次增大,A元素阳离子的原子核外没有电子,则A为H元素;
B是空气中含量最多的元素,B为N元素;
C元素原子最外层电子数是其电子层数的三倍,最外层电子数为6,故C为氧元素或硫元素,且C与D可形成两种常见的离子化合物,故C为O元素、D为Na元素;
工业上常用电解C与E的化合物来制备E单质,E为Al元素,
根据分析可知:A为H元素、B为N元素、C为O元素、D为Na元素、E为Al元素,据此进行分析解答.
B是空气中含量最多的元素,B为N元素;
C元素原子最外层电子数是其电子层数的三倍,最外层电子数为6,故C为氧元素或硫元素,且C与D可形成两种常见的离子化合物,故C为O元素、D为Na元素;
工业上常用电解C与E的化合物来制备E单质,E为Al元素,
根据分析可知:A为H元素、B为N元素、C为O元素、D为Na元素、E为Al元素,据此进行分析解答.
解答:
解:短周期元素A、B、C、D、E的原子序数依次增大,A元素阳离子的原子核外没有电子,则A为氢元素;B是空气中含量最多的元素,B为氮元素;C元素原子最外层电子数是其电子层数的三倍,最外层电子数为6,故C为氧元素或硫元素,且C与D可形成两种常见的离子化合物,故C为氧元素、D为Na元素;工业上常用电解C与E的化合物来制备E单质,E为Al元素,
(1)D为Na元素,Na原子核外电子数为11,有3个电子层,各层电子数为2、8、1,原子结构示意图为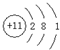 ;
;
C为O元素、D为Na元素、E为Al元素,电子层结构相同核电荷数越大离子半径越小,故C、D、E的简单离子半径由小到大的顺序为:Al3+<Na+<O2-,
故答案为: ;Al3+<Na+<O2-;
;Al3+<Na+<O2-;
(2)A为H元素、B为N元素,工业上常用A和B的单质合成一种常见气体为NH3,分子中氮原子与氢原子之间形成1对共用电子对,该气体的电子式 为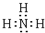 ,检验氨气的常用方法是:用润湿的红色石蕊试纸接近该气体,若试纸变蓝,证明氨气存在,
,检验氨气的常用方法是:用润湿的红色石蕊试纸接近该气体,若试纸变蓝,证明氨气存在,
故答案为: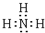 ;用润湿的红色石蕊试纸接近该气体,若试纸变蓝,证明氨气存在;
;用润湿的红色石蕊试纸接近该气体,若试纸变蓝,证明氨气存在;
(3)C为O元素、D为Na元素,D2C2为过氧化钠,Na2O2与H2O反应生成NaOH与O2,化学方程式为:2Na2O2+2H2O=4NaOH+O2↑;
Na2O2与CuSO4溶液反应,首先与H2O反应生成NaOH与O2,然后NaOH与CuSO4溶液反应生成Cu(OH)2,反应现象是:产生蓝色沉淀并有气泡放出,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;产生蓝色沉淀并有气泡放出;
(4)A为H元素、B为N元素、C为O元素,A、B、C三种元素可组成一种常见离子化合物,其水溶液呈酸性,该离子化合物为NH4NO3,溶液中NH4+水解,使溶液呈酸性,故c(NO3-)>c(NH4+),c(H+)>c(OH-),水解程度很小,溶液中c(NH4+)>c(H+),故溶液中离子浓度由大到小的顺序为:c(NO3-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(NO3-)>c(NH4+)>c(H+)>c(OH-).
(1)D为Na元素,Na原子核外电子数为11,有3个电子层,各层电子数为2、8、1,原子结构示意图为
 ;
;C为O元素、D为Na元素、E为Al元素,电子层结构相同核电荷数越大离子半径越小,故C、D、E的简单离子半径由小到大的顺序为:Al3+<Na+<O2-,
故答案为:
 ;Al3+<Na+<O2-;
;Al3+<Na+<O2-;(2)A为H元素、B为N元素,工业上常用A和B的单质合成一种常见气体为NH3,分子中氮原子与氢原子之间形成1对共用电子对,该气体的电子式 为
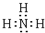 ,检验氨气的常用方法是:用润湿的红色石蕊试纸接近该气体,若试纸变蓝,证明氨气存在,
,检验氨气的常用方法是:用润湿的红色石蕊试纸接近该气体,若试纸变蓝,证明氨气存在,故答案为:
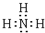 ;用润湿的红色石蕊试纸接近该气体,若试纸变蓝,证明氨气存在;
;用润湿的红色石蕊试纸接近该气体,若试纸变蓝,证明氨气存在;(3)C为O元素、D为Na元素,D2C2为过氧化钠,Na2O2与H2O反应生成NaOH与O2,化学方程式为:2Na2O2+2H2O=4NaOH+O2↑;
Na2O2与CuSO4溶液反应,首先与H2O反应生成NaOH与O2,然后NaOH与CuSO4溶液反应生成Cu(OH)2,反应现象是:产生蓝色沉淀并有气泡放出,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;产生蓝色沉淀并有气泡放出;
(4)A为H元素、B为N元素、C为O元素,A、B、C三种元素可组成一种常见离子化合物,其水溶液呈酸性,该离子化合物为NH4NO3,溶液中NH4+水解,使溶液呈酸性,故c(NO3-)>c(NH4+),c(H+)>c(OH-),水解程度很小,溶液中c(NH4+)>c(H+),故溶液中离子浓度由大到小的顺序为:c(NO3-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(NO3-)>c(NH4+)>c(H+)>c(OH-).
点评:本题以元素推断为载体,考查结构性质位置关系、常用化学用语书写、元素化合物性质等、离子半径比较、离子浓度比较等知识,题目难度中等,注意明确原子结构与元素周期表、元素周期律的关系.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
用惰性电极电解500mLCu(NO3)2溶液一段时间后,停止电解,向所得溶液中加入0.1molCu(OH)2,恰好完全反应时,溶液浓度刚好回复至电解前.则下列说法不正确的是( )
| A、电解前电解质溶液的浓度为0.2mol/L(假设溶液体积不变) |
B、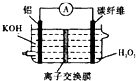 若用Al--H2O2电池(如图)为电解的电源,则理论上应消耗Al的质量为2.7g |
| C、若向电解后溶液中加入Fe和Fe2O3的混合物至恰好完全溶解,得到标况下0.896LNO气体,所得溶液中加KSCN溶液,无血色出现,则溶液的混合物中含铁元素的质量为4.48g |
| D、阳极产生O2在标况下体积为2.24L |
将一定量的Ag2SO4固体置于容积不变的容器中,在某温度下发生下列反应:
Ag2SO4(s)?Ag2O(s)+SO3(g) 2SO3(g)?2SO2(g)+O2(g)
经10分钟反应达到平衡,此时c(SO3)=0.4mol/L,c(O2)=0.05mol/L,下列叙述不正确的是( )
Ag2SO4(s)?Ag2O(s)+SO3(g) 2SO3(g)?2SO2(g)+O2(g)
经10分钟反应达到平衡,此时c(SO3)=0.4mol/L,c(O2)=0.05mol/L,下列叙述不正确的是( )
| A、SO3的分解率为20% |
| B、10分钟内ν(SO2)=0.01mol/(L?min) |
| C、容器内气体的密度为40g/L |
| D、加压,容器内固体的质量不变 |




 .
. (NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.实验步骤如下:
(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.实验步骤如下: