题目内容
在全球号召节能减排的大背景下,2010年两会期间,政协委员们领到的会议通知、日程表、便签纸等都是以碳酸钙为主要原料的低碳“石头纸”.某化学探究小组的同学为了测定“石头纸”中碳酸钙的含量,称取了5.0g碎纸样品.实验数据记录见下表(假设石头纸中其他成分既不溶于水,也不与水反应):
则样品中碳酸钙的质量分数为( )
| 实验组别 | ① | ② | ③ | ④ | ⑤ |
| 加入样品的质量/g | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 |
| 加入0.2mol/L稀盐酸的体积/mL | 20.0 | 40.0 | 60.0 | 80.0 | 100.0 |
| 充分反应后生成标准状况下气体的体积/mL | 44.8 | 89.6 | 134.4 | 179.2 | 179.2 |
| A、20% | B、40% |
| C、60% | D、80% |
考点:探究物质的组成或测量物质的含量,化学方程式的有关计算
专题:实验探究和数据处理题
分析:分析数据得到,前4组实验中加入的盐酸体积成倍增加,生成的二氧化碳体积也是成倍增加,但实验④与实验⑤气体体积不再有差别,故实验④中碳酸钙完全反应,生成的二氧化碳的物质的量为0.008 mol,即反应的碳酸钙为
=0.008 mol,根据碳守恒,所以样品中碳酸钙的质量分数为
×100%=80%.
| 179.2×10 -3L |
| 22.4L/mol |
| 0.008mol×100g/mol |
| 1.0g |
解答:
解:分析数据得到,前4组实验中加入的盐酸体积成倍增加,生成的二氧化碳体积也是成倍增加,但实验④与实验⑤气体体积不再有差别,故实验④中碳酸钙完全反应,生成的二氧化碳的物质的量为0.008 mol,即反应的碳酸钙为
=0.008 mol,根据碳守恒,所以样品中碳酸钙的质量分数为
×100%=80%,故选;D;
| 179.2×10 -3L |
| 22.4L/mol |
| 0.008mol×100g/mol |
| 1.0g |
点评:本题主要考查了利用多次对比实验来测定“石头纸”中碳酸钙的含量,关键要根据实验数据分析找出固体和酸的用量关系,难度不大;

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
第3周期元素形成的单质中,属于原子晶体的是( )
| A、金刚砂 | B、金刚石 |
| C、单晶硅 | D、二氧化碳 |
用惰性电极电解500mLCu(NO3)2溶液一段时间后,停止电解,向所得溶液中加入0.1molCu(OH)2,恰好完全反应时,溶液浓度刚好回复至电解前.则下列说法不正确的是( )
| A、电解前电解质溶液的浓度为0.2mol/L(假设溶液体积不变) |
B、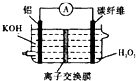 若用Al--H2O2电池(如图)为电解的电源,则理论上应消耗Al的质量为2.7g |
| C、若向电解后溶液中加入Fe和Fe2O3的混合物至恰好完全溶解,得到标况下0.896LNO气体,所得溶液中加KSCN溶液,无血色出现,则溶液的混合物中含铁元素的质量为4.48g |
| D、阳极产生O2在标况下体积为2.24L |
仅用下表提供的仪器(夹持仪器和试剂任选)不能达到相应实验目的是( )
| A、用盐酸除去BaSO4中混有的少量BaCO3 漏斗,烧杯、玻璃棒、胶头滴管、滤纸 |
| B、从食盐水中获得NaCl晶体酒精灯、玻璃棒、坩埚、泥三角 |
| C、用0.l0mol?L-1的盐酸测定未知浓度的NaOH溶液 碱式滴定管、酸式滴定管、锥形瓶、烧杯 |
| D、用溴水和CCl4除去NaBr溶液中少量NaI 烧杯、玻璃棒、胶头滴管、分液漏斗 |
将一定量的Ag2SO4固体置于容积不变的容器中,在某温度下发生下列反应:
Ag2SO4(s)?Ag2O(s)+SO3(g) 2SO3(g)?2SO2(g)+O2(g)
经10分钟反应达到平衡,此时c(SO3)=0.4mol/L,c(O2)=0.05mol/L,下列叙述不正确的是( )
Ag2SO4(s)?Ag2O(s)+SO3(g) 2SO3(g)?2SO2(g)+O2(g)
经10分钟反应达到平衡,此时c(SO3)=0.4mol/L,c(O2)=0.05mol/L,下列叙述不正确的是( )
| A、SO3的分解率为20% |
| B、10分钟内ν(SO2)=0.01mol/(L?min) |
| C、容器内气体的密度为40g/L |
| D、加压,容器内固体的质量不变 |
 ;
;
 (NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.实验步骤如下:
(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.实验步骤如下: