题目内容
7.已知:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-282.9kJ/mol
某H2与CO的混合气体完全燃烧放出113.74kJ热量,同时生成3.6g液态水,则原混合气体中H2与CO的物质的量之比是( )
| A. | 1:1 | B. | 1:3 | C. | 1:4 | D. | 2:3 |
分析 根据n=$\frac{m}{M}$计算出生成水的物质的量,然后根据质量守恒定律可知混合气体中氢气的物质的量,然后根据热化学方程式计算出氢气燃烧放出热量,结合放出的总热量可计算出CO燃烧放出的热量,再根据CO的燃烧热计算出CO的物质的量;相同条件下气体的体积之比等于物质的量之比,据此可计算出原混合气体中H2与CO的物质的量之比.
解答 解:根据反应2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol、CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-282.9kJ/mol可知氢气的燃烧为285.8kJ/mol,CO的燃烧热为282.9kJ/mol,
3.6g液态水的物质的量为:$\frac{3.6g}{18g/mol}$=0.2mol,根据H元素守恒可知原混合气体中含有氢气的物质的量为:n(H2)=n(H2O)=0.2mol,0.2mol氢气完全燃烧放出的热量为:285.8kJ/mol×0.2mol=57.16kJ,
则混合气体中CO完全燃烧放出的热量为:113.74kJ-57.16kJ=56.58kJ,则CO的物质的量为:n(CO)=$\frac{56.58kJ}{282.9kJ/mol}$=0.2mol,
相同条件下气体的体积之比等于物质的量之比,则原混合气体中H2与CO的物质的量之比=0.2mol:0.2mol=1:1,
故选A.
点评 本题考查了热化学方程式,题目难度不大,明确燃烧热的概念及应用为解答关键,注意掌握热化学方程式的书写原则及表示意义,试题培养了学生的化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.随着卤素原子核电荷数的递增,下列递变规律正确的是( )
| A. | 单质的熔沸点逐渐升高 | B. | 氢化物的稳定性逐渐增强 | ||
| C. | 单质的氧化性逐渐增强 | D. | 元素的非金属性逐渐增强 |
15.化学与生产、生活息息相关,下列有关说法错误的是( )
| A. | 大量燃烧化石燃料是造成雾霾天气的原因之一 | |
| B. | 燃料脱硫和减少汽车尾气排放都能减少酸雨的产生 | |
| C. | 从海水中提取物质都必须通过化学反应才能实现 | |
| D. | 用食醋可以除去热水壶内壁的水垢 |
2.化学物质通常都有其“功”与“过”,以下对化学物质的评价不符合事实的是( )
| A. | 氧气可供人呼吸但会使食物变质 | |
| B. | 化肥能促进植物生长但会污染土壤 | |
| C. | 一氧化碳可用于冶炼金属但会使人中毒 | |
| D. | 二氧化碳能灭火但会造成酸雨 |
12.为了更好地表示溶液的酸碱度,科学家提出了酸度(AG)的概念.定义:AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$,则下列叙
述中正确的是( )
述中正确的是( )
| A. | 中性溶液AG=0 | |
| B. | 酸性溶液AG>0 | |
| C. | 常温下0.1mol/L的氢氧化钠溶液的AG=12 | |
| D. | 常温下0.1mol/L的醋酸溶液的AG=12 |
19.下列情况下,反应速率相同的是( )
| A. | 等体积0.1mol/L HCl和0.01mol/L HCl反应 | |
| B. | 等质量锌粒和镁粉分别与等量1 mol/L HCl反应 | |
| C. | 等体积等浓度HCl和HNO3分别与等量1 mol/L碳酸钠溶液 | |
| D. | 等体积0.2 mol/HCl 和0.1 mol/L H2SO4 与等量等表面积的石灰反应 |
17.下列说法中正确的是( )
| A. | 相对分子质量相同的物质是同种物质 | |
| B. | 分子组成相差若干个CH2的两种有机物互为同系物 | |
| C. | 分子式相同的不同有机物一定是同分异构体 | |
| D. | 符合通式CnH2n+2的不同烃一定互为同系物 |
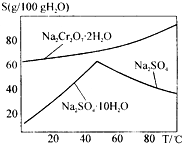 如图是红矾钠Na2Cr2O7•2H2O和Na2SO4的溶解度曲线.现欲对两种物质进行分离,操作I的方法是先对加热后的混合溶液进行②,以得到硫酸钠晶体;然后操作II是①,得到红矾钠晶体.(填编号)
如图是红矾钠Na2Cr2O7•2H2O和Na2SO4的溶解度曲线.现欲对两种物质进行分离,操作I的方法是先对加热后的混合溶液进行②,以得到硫酸钠晶体;然后操作II是①,得到红矾钠晶体.(填编号)