题目内容
2.下列说法中不正确的是( )| A. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| B. | 物质燃烧和酸碱中和均放出热量 | |
| C. | 需要加热的反应肯定是吸热反应 | |
| D. | 化学反应是吸热的还是放热的取决于生成物具有的总能量和反应物具有的总能量的相对大小 |
分析 A、化学反应除物质变化外还有能量变化;
B、物质燃烧和酸碱中和反应均是放热反应;
C、反应吸热还是放热与反应条件无关,决定于反应物和生成物的能量高低;
D、化学反应中生成物总能量不等于反应物的总能量,反应前后的能量差值为化学反应中的能量变化;
解答 解:A、化学反应既有物质变化又有能量变化,故A正确;
B、物质燃烧和酸碱中和反应均是放热反应,放出热量,故B正确;
C、反应吸热还是放热与反应条件无关,故C错误;
D、放热反应是指:反应物所具有的总能量高于生成的总能量,在反应中会有一部分能量转变为热能的形式释放,反之,就是吸热反应,故D正确;
故选C.
点评 本题考查了化学变化过程中的热效应,题目难度不大,正确理解放、热吸热的本质是解题的关键.

练习册系列答案
相关题目
2.大苏打是五水合硫代硫酸钠(Na2S2O3•5H2O)的俗称,又称海波,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成.向Na2CO3和Na2S混合溶液中通入SO2反应后制得Na2S2O3•5H2O,通常制得的产品含有少量Na2SO3和Na2SO4.
Ⅰ、某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O),实验装置如图所示(省略夹持装置):
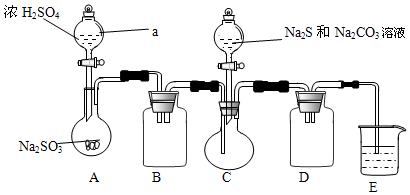
实验步骤:
(1)检查装置气密性,按图示加入试剂.仪器a的名称是分液漏斗,组装仪器之前必须检查仪器a是否漏水的操作是关闭活塞,向分液漏斗内注入一定量水,观察活塞是否漏水,旋转活塞1800观察活塞是否漏水.E中NaOH溶液的作用是吸收SO2,防止污染空气.
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加H2SO4.A装置中发生反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(3)待C反应结束后,过滤其混合物,将滤液蒸发浓缩、结晶、过滤、洗涤、干燥,得到产品.
Ⅱ.【探究与反思】
(4)为验证产品 中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整.(所需试剂从稀HNO3、稀H2SO4、稀HCl、BaCl2溶液、蒸馏水中选择)
(5)为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤(2)进行了改进,改进后的操作是先向A中烧瓶滴加浓H2SO4,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3混合溶液.
(6)为测定所得样品中Na2S2O3•5H2O的纯度,称取mg产品配成稀溶液并除去Na2SO3和Na2SO4,然后用c mol•L-1标准碘溶液进行滴定(用淀粉溶液作指示剂),反应方程式为2Na2S2O3+I2═2NaI+Na2S4O6.若三次滴定平均消耗碘溶液的体积为V mL,则测量的Na2S2O3•5H2O的纯度为$\frac{49.6cV}{m}$%.(已知Na2S2O3•5H2O的式量是248)
Ⅰ、某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O),实验装置如图所示(省略夹持装置):

实验步骤:
(1)检查装置气密性,按图示加入试剂.仪器a的名称是分液漏斗,组装仪器之前必须检查仪器a是否漏水的操作是关闭活塞,向分液漏斗内注入一定量水,观察活塞是否漏水,旋转活塞1800观察活塞是否漏水.E中NaOH溶液的作用是吸收SO2,防止污染空气.
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加H2SO4.A装置中发生反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(3)待C反应结束后,过滤其混合物,将滤液蒸发浓缩、结晶、过滤、洗涤、干燥,得到产品.
Ⅱ.【探究与反思】
(4)为验证产品 中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整.(所需试剂从稀HNO3、稀H2SO4、稀HCl、BaCl2溶液、蒸馏水中选择)
| 实验操作 | 现象 | 结论 |
| 取适量产品配成稀溶液,滴加足量BaCl2溶液 | 有白色沉淀生成 | |
| 过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀HCl | 沉淀部分溶解,并有刺激性气味的气体产生 | 确定产品中含有Na2SO3和Na2SO4 |
(6)为测定所得样品中Na2S2O3•5H2O的纯度,称取mg产品配成稀溶液并除去Na2SO3和Na2SO4,然后用c mol•L-1标准碘溶液进行滴定(用淀粉溶液作指示剂),反应方程式为2Na2S2O3+I2═2NaI+Na2S4O6.若三次滴定平均消耗碘溶液的体积为V mL,则测量的Na2S2O3•5H2O的纯度为$\frac{49.6cV}{m}$%.(已知Na2S2O3•5H2O的式量是248)
13.某化学兴趣小组用如图所示装置制取氯酸钾、次氯酸钠和氯水并进行探究实验.
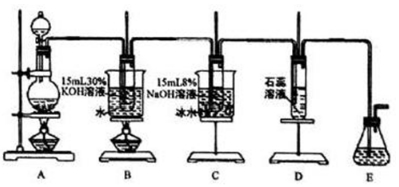
实验I.制取氮酸钾、次氯酸钠和氯水
(1)写出装置A实验室制取Cl2的化学反应方程式Mn2O+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)制取实验结束后,取出装置B中的试管,冷却结晶、过滤、洗涤,该实验操作过程需要的玻璃仪器有胶头滴管、烧杯、漏斗、玻璃棒.为提高氯酸钾和次氯酸钠的产率,在实验装置中还需要改进的是在A和B之间添加盛有饱和NaCl的洗气装置.
(3)装置 C 中反应需要在冰水浴中进行,其原因是温度升高会生成氯酸钠.
(4)装置D中的实验现象是溶液先变红后褪色,最后又变为黄绿色.
实验Ⅱ尾气处理
实验小组利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理.
(5)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中的CO2的影响)
①提出合理假设
假设1:只存在SO32-;
假设2:既不存在SO32-也不存在ClO-;
假设 3:只存在ClO.
②设计实验方案,进行实验.请在答题卡上写出实验步骤以及预期现象和结论.限选实验试剂:3mol/L H2SO4、1mol/LNaOH 溶液、0.01mol/L 酸性 KMnO4 溶液、淀粉 KI 溶液.

实验I.制取氮酸钾、次氯酸钠和氯水
(1)写出装置A实验室制取Cl2的化学反应方程式Mn2O+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)制取实验结束后,取出装置B中的试管,冷却结晶、过滤、洗涤,该实验操作过程需要的玻璃仪器有胶头滴管、烧杯、漏斗、玻璃棒.为提高氯酸钾和次氯酸钠的产率,在实验装置中还需要改进的是在A和B之间添加盛有饱和NaCl的洗气装置.
(3)装置 C 中反应需要在冰水浴中进行,其原因是温度升高会生成氯酸钠.
(4)装置D中的实验现象是溶液先变红后褪色,最后又变为黄绿色.
实验Ⅱ尾气处理
实验小组利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理.
(5)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中的CO2的影响)
①提出合理假设
假设1:只存在SO32-;
假设2:既不存在SO32-也不存在ClO-;
假设 3:只存在ClO.
②设计实验方案,进行实验.请在答题卡上写出实验步骤以及预期现象和结论.限选实验试剂:3mol/L H2SO4、1mol/LNaOH 溶液、0.01mol/L 酸性 KMnO4 溶液、淀粉 KI 溶液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol•L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 | ------------- |
| 步骤2: 向A试管中加入1-2mL 0.0lmol•L-1 KMnO4溶液,振荡试管 | (1)若溶液褪色,则假设1成立 (2)若溶液不褪色,则假设2或3成立 |
| 步骤3: 向B试管中滴加1-2滴淀粉-KI溶液 | (1)若溶液变蓝,则假设成立 (2)若溶液不变蓝,综合步骤中的(2),则假设2成立 |
10.某强酸性溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如图:
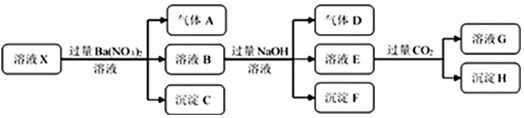
下列有关推断合理的是( )

下列有关推断合理的是( )
| A. | 若要确定溶液X中是否含有Fe3+,其操作为取少量原溶液于试管中,加入适量KSCN溶液,溶液变血红色,则含有Fe3+ | |
| B. | 沉淀C为BaSO4,沉淀H为BaCO3 | |
| C. | 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- | |
| D. | 若溶液X为100mL,产生的气体A为112mL(标况),则X中c(Fe2+)=0.05mol•L-1 |
17.短周期元素X、Y、Z、W在周期表中的相对位置如图所示,其中W元素的原子结构示意图为 .请回答下列问题:
.请回答下列问题:
(1)Z元素位于元素周期表中第三周期VA族.
(2)X元素的最简单气态氢化物能与其最高价氧化物对应的水化物反应,得到的化合物属于离子化合物 (填“离子化合物”或“共价化合物”).
(3)X、Y、Z三种元素的原子半径由大到小的顺序为P>N>O(用元素符号表示).
(4)写出W单质与X的最高价氧化物对应水化物的浓溶液反应的化学方程式:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
 .请回答下列问题:
.请回答下列问题:| W | X | Y |
| Z |
(2)X元素的最简单气态氢化物能与其最高价氧化物对应的水化物反应,得到的化合物属于离子化合物 (填“离子化合物”或“共价化合物”).
(3)X、Y、Z三种元素的原子半径由大到小的顺序为P>N>O(用元素符号表示).
(4)写出W单质与X的最高价氧化物对应水化物的浓溶液反应的化学方程式:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
7.根据如图所示的N2(g)和O2(g)反应生成NO(g)过程中能量变化情况,判断下列说法错误的是
( )
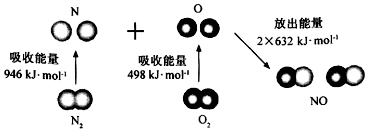
( )

| A. | 直观看,该反应中反应物所具有的总能量低于生成物所具有的总能量 | |
| B. | 2 mol气态氧原子结合生成O2(g)时,能放出498 KJ能量 | |
| C. | 断裂1 mol NO分子中的化学键,需要吸收632KJ能量 | |
| D. | 该反应的热化学方程式为:N2+O2═2NO△H=+180KJ/mol. |
14.下列变化需克服共价键的是( )
| A. | 干冰受热变成二氧化碳气体 | B. | 金刚石熔化 | ||
| C. | 蔗糖溶于水 | D. | 食盐溶于水 |
11.汽车尾气处理时发生反应:4CO+2NO2?N2+4CO2.在不同条件下的化学反应速率不同,下列表示反应速率最慢的是( )
| A. | v(CO)=0.03mol•L-1•s-1 | B. | v(NO2)=0.7mol•L-1•min-1 | ||
| C. | v(N2)=0.4mol•L-1•min-1 | D. | v(CO2)=1.1mol•L-1•min-1 |