题目内容
13.现有(NH4)2SO4、NH4NO3两种化肥,你认为哪种适宜用于酸性土壤?说明理由.分析 根据农作物对两种化肥的吸收情况以及两种化肥的组成分析:植物吸收营养元素的原理是通过交换吸附来进行的,吸附之后不能改变土壤酸碱性的肥料适宜,两种肥料的区别是(NH4)2SO4只有阳离子含有植物营养元素N元素,而NH4NO3中阴阳离子都含有N元素,且施用(NH4)2SO4时,交换吸附后进入土壤的H+多,吸收SO42-少,土壤显酸性,据此分析.
解答 解:植物吸收营养元素的原理是通过交换吸附来进行的,(NH4)2SO4只有阳离子含有植物营养元素N元素,而NH4NO3中阴阳离子都含有N元素,施用(NH4)2SO4时,植物需氮多,吸收NH4+多,吸收SO42-少.交换吸附后进入土壤的H+多,使土壤显酸性,故不适于酸性土壤;若用NH4NO3,植物对NH4+和NO3-的吸收量相同,交换吸附后进入土壤的H+和OH-的量相同,不会增加土壤的酸性,故适于酸性土壤,
答:施用(NH4)2SO4时,吸收NH4+多,吸收SO42-少,容易使土壤的酸性更强,施用NH4NO3时,植物对NH4+和NO3-的吸收量相同,对土壤的影响比硫酸铵小.
点评 本题考查酸性土壤中氮肥的选择,掌握植物对土壤中营养元素吸收的原理,了解不同的肥料被吸收的方式的不同是解题的关键,题目难度不大.

练习册系列答案
相关题目
3.已知化学反应①:
Fe(s)+CO2(g)═FeO(s)+CO(g),其平衡常数为K1;化学反应②:
Fe(s)+H2O(g)═FeO(s)+H2(g),其平衡常数为K2.在温度
973K和1173K情况下,K1、K2的值分别如下:
(1)通过表格中的数值可以推断:反应①是吸热(填“吸热”或“放热”)反应.
(2)现有反应③:CO2(g)+H2(g)=CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$.
(3)根据反应①与②可推导出K1、K2与K3之间的关系式K3=$\frac{{K}_{1}}{{K}_{2}}$.据此关系式及上表数据,也能推断出反应③是吸热(填“吸热”或“放热”)反应,要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有DF(填写序号).
A.缩小反应容器容积 B.扩大反应容器容积
C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的量
(4)图甲、乙分别表示反应③在t1时刻达到平衡、在t2时刻因改变某个条件而发生变化的情况:
①图甲中t2时刻发生改变的条件是加入催化剂或增大体系的压强.
②图乙中t2时刻发生改变的条件是降低温度或增加水蒸气的量或减少氢气的量.

Fe(s)+CO2(g)═FeO(s)+CO(g),其平衡常数为K1;化学反应②:
Fe(s)+H2O(g)═FeO(s)+H2(g),其平衡常数为K2.在温度
973K和1173K情况下,K1、K2的值分别如下:
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
(2)现有反应③:CO2(g)+H2(g)=CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$.
(3)根据反应①与②可推导出K1、K2与K3之间的关系式K3=$\frac{{K}_{1}}{{K}_{2}}$.据此关系式及上表数据,也能推断出反应③是吸热(填“吸热”或“放热”)反应,要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有DF(填写序号).
A.缩小反应容器容积 B.扩大反应容器容积
C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的量
(4)图甲、乙分别表示反应③在t1时刻达到平衡、在t2时刻因改变某个条件而发生变化的情况:
①图甲中t2时刻发生改变的条件是加入催化剂或增大体系的压强.
②图乙中t2时刻发生改变的条件是降低温度或增加水蒸气的量或减少氢气的量.

8.下列金属最易与H2O发生反应的是( )
| A. | Na | B. | K | C. | Al | D. | Mg |
18.下列事实不能用勒夏特列原理解释的是( )
| A. | 黄绿色的氯水光照后颜色变浅 | |
| B. | 在硫酸亚铁溶液中,加入铁粉以防止氧化变质 | |
| C. | 生产硝酸的过程中使用过量空气以提高氨气的利用率 | |
| D. | 实验室常用排饱和食盐水的方法收集氯气 |
5.下列说法正确的是( )
| A. | 二元弱酸酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) | |
| B. | 一定量的(NH4)2SO4与NH3•H2O混合的酸性溶液中:c(NH4+)>2c(SO42-) | |
| C. | 物质的量浓度均为0.01mol/L的CH3COOH和CH3COONa的溶液等体积混合后溶液中 c(CH3COOH)+c(CH3COO-)=0.02 mol/L | |
| D. | 物质的量浓度相等的①NH4HSO4溶液、②NH4HCO3溶液、③NH4Cl溶液中c(NH4+):①>③>② |
 盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就硫酸、硝酸与金属铜反应的情况,回答下列问题:
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就硫酸、硝酸与金属铜反应的情况,回答下列问题:
 .
. →
→ +2H2O.
+2H2O. .
.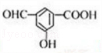 .
.