题目内容
18.已知:充分燃烧a g乙炔(C2H2)气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则表示乙炔燃烧热的热化学方程式正确的是( )| A. | C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l);△H=-2b kJ•mol-1 | |
| B. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=-4b kJ•mol-1 | |
| C. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g);△H=-4b kJ•mol-1 | |
| D. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=b kJ•mol-1 |
分析 燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,由物质的物质的量与反应放出的热量成正比可知,1mol乙炔完全燃烧生成2mol二氧化碳气体和液态水时放出热量为2bkJ,则乙炔燃烧热的热化学方程式为:C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-2b kJ•mol-1.
解答 解:根据题意知:燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,
A.由物质的物质的量与反应放出的热量成正比可知,生成2mol二氧化碳气体和液态水,并放出热量2bkJ,则乙炔燃烧热的热化学方程式为:C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l);△H=-2b kJ•mol-1,故A正确;
B.乙炔燃烧热可燃物的系数要求必须是1mol,故B错误;
B.由物质的物质的量与反应放出的热量成正比可知,生成2mol二氧化碳气体和液态水,并放出热量2bkJ,△H=+2b kJ/mol表示吸收热量,故B错误;
C.燃烧热的热化学方程式中,水的状态必须为液态,且乙炔的计量数必须为1,故C错误;
D.乙炔的计量数必须为1,且必须标出焓变的正负值,故D错误;
故选A.
点评 本题考查了热化学方程式的书写,题目难度不大,明确燃烧热的概念为解答关键,注意掌握热化学方程式的书写原则,试题有利于提高学生的灵活应用能力.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
8.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 在常温常压下,11.2 LN2含有的分子数为0.5 NA | |
| B. | 在常温常压下,1molNe含有的原子数为NA | |
| C. | 71gCl2所含原子数为NA | |
| D. | 在同温、同压下,相同体积的任何气体单质所含的原子数相同 |
6.在2L容积不变的容器中,发生3A(g)+B(g)?2C(g)+2D(g)的反应.现通入3mol A和2.5mol B,5s内用C表示的反应速率为0.1mol•L-1•s-1,则5s时容器中A的物质的量浓度是( )
| A. | 0.75 mol•L-1 | B. | 1.5 mol•L-1 | C. | 2 mol•L-1 | D. | 0.15 mol•L-1 |
13.在容积不变的密闭容器中,可逆反应H2(g)+I2(g)?2HI(g)达到平衡的标志( )
| A. | H2、I2、HI的浓度之比1:1:2 | |
| B. | H2、I2、HI的浓度保持不变 | |
| C. | 混合气体的密度保持不变 | |
| D. | 容器内气体的总压强不随时间变化而变化 |
7.下列各说法正确的是( )
| A. | 弱电解质的导电能力一定比强电解质的导电能力弱 | |
| B. | pH=4的醋酸与pH=10的NaOH溶液等体积混合后溶液显碱性 | |
| C. | 豆浆中加入硫酸钙会使蛋白质聚沉. | |
| D. | 同浓度的①NaHCO3②Na2CO3③CH3COONa四种溶液,pH值大小排列顺序是②>①>③ |
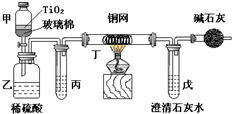 电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率.
电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率.
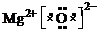 .
.